
| A. | 含磷洗涤剂中的Na5P3O10中磷的化合价为+7价 | |
| B. | 有多少种元素就一定有多少种单质 | |
| C. | 金刚石、石墨和C60全部以游离态存在 | |
| D. | 含多种元素的物质一定是混合物 |
分析 A.在化合物中元素的化合价的代数和为零,已知Na为+1价,O为-2价,据此分析.
B.根据元素存在同素异形体;
C.元素以单质形式存在的属于元素的游离态,元素以化合物形式存在的属于元素的化合态,
D.含多种元素的物质不一定是混合物,也可能是纯净物;
解答 解:A.在化合物中元素的化合价的代数和为零,已知Na为+1价,O为-2价,则Na5P3O10中磷元素的化合价为+5价,故A错误;
B.元素存在同素异形体,如氧元素由氧气与臭氧,所以元素的种类远小于单质的种类,故B错误;
C.金刚石、石墨、C60都是碳元素组成的不同单质,碳元素以游离态存在,故C正确;
D.含多种元素的物质不一定是混合物,也可能是纯净物,如KClO3含有3种元素,但属于纯净物,故D错误;
故选C.
点评 本题主要考查了化合价的确定、元素的存在形式、物质的组成等,难度不大,注意概念的辨析.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热233kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
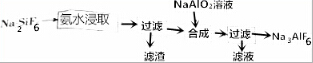
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铜和稀硫酸的混合物中加入某无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 | |
| B. | 用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 | |
| C. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 | |
| D. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色,说明Fe3+的氧化性大于I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子 | |
| B. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| C. | 标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2 | |
| B. | 酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定 | |
| C. | 将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗放出碘的苯溶液 | |
| D. | 在溴化钠中加入少量的乙醇,再加入2倍于乙醇的1﹕1的硫酸制取溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
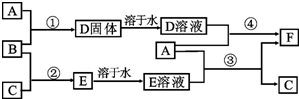 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com