
| A. | 汽油燃烧 | B. | 铝热反应 | C. | 液氨汽化 | D. | 酸碱中和 |
分析 物质在溶解时经常伴随有吸热或放热现象,氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低,电离、水解都是吸热过程;
常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A.汽油燃烧是放热反应,故A错误;
B.铝热反应是金属之间的置换,属于放热反应,故B错误;
C.液氨气化,需要吸收热量,故C正确;
D.酸碱中和属于放热反应,故D错误.
故选C.
点评 本题难度不大,考查化学中吸热或放热问题,熟记吸热或放热的判断规律是正确解答此类题的关键,对于特殊过程中的热量变化的要熟练记忆.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
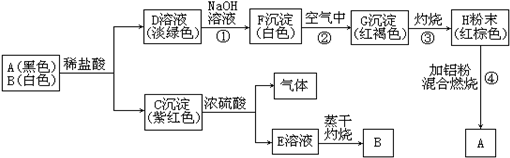
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| C. | 1 mo1 Na被氧化成Na2O2,失去电子数目为2 NA | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
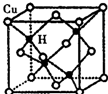 铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).
铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇难溶于水 | B. | 乙烯可使酸性KMnO4溶液褪色 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 苯不能萃取碘水中的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
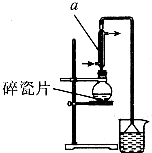 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如下:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如下:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com