
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示. 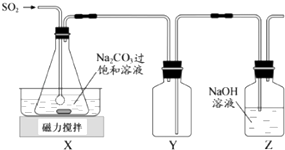
当溶液pH约为4时,停止反应.在20℃左右静置结晶.生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体.用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4 , 其可能的原因是
【答案】
(1)2SO2+CO32﹣+H2O=2HSO3﹣+CO2
(2)防止倒吸
(3)吸滤瓶;减少Na2S2O5在水中的溶解
(4)在制备过程中Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化生成Na2SO4
【解析】解:(1)向Na2CO3过饱和溶液中通入SO2 , 发生反应生成NaHSO3和CO2 , 反应的离子方程式为2SO2+CO32﹣+H2O=2HSO3﹣+CO2 ,
所以答案是:2SO2+CO32﹣+H2O=2HSO3﹣+CO2;(2)二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸,所以答案是:防止倒吸;(3)①组成减压抽滤装置的主要仪器是布氏漏斗、吸滤瓶和抽气泵,所以答案是:吸滤瓶;②由反应2NaHSO3═Na2S2O5+H2O可知,增大HSO3﹣的浓度,有利于生成Na2S2O5 , 用饱和SO2水溶液洗涤,可降低Na2S2O5的溶解度,减少Na2S2O5的溶解,
所以答案是:减少Na2S2O5在水中的溶解;(4)Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化,可知验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 ,
所以答案是:在制备过程中Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化生成Na2SO4 .


科目:高中化学 来源: 题型:
【题目】下列有关化学实验安全问题的叙述中不正确的是
A.少量的浓硫酸沾到皮肤上时,可以直接用大量的水冲洗
B.取用化学药品时,应特别注意观察药品包装上的安全警示标记
C.凡是给玻璃仪器加热时,都要加垫石棉网,以防仪器炸裂
D.闻任何化学药品的气味都不能使鼻子凑近药品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.反应CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓H2SO4氧化成CO2 , 选用下图所示仪器(内含物质)组装成实验装置: 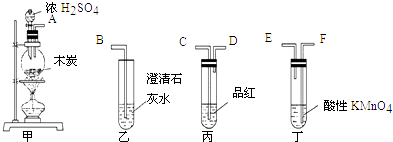
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):接 , 接 , 接;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中 , 丙中;
(3)丁中酸性KMnO4溶液的作用是;
(4)写出甲中反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的NH3·H2O溶液中存在如下电离平衡:NH3·H2O![]() NH4++OH-对于该平衡,下列叙述正确的是
NH4++OH-对于该平衡,下列叙述正确的是
A. 加入少量NaOH固体,溶液中c(OH-)减少
B. 通入少量HCl气体,平衡向正反应方向移动
C. 加入少量水,平衡向逆反应方向移动
D. 加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.己知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-
H++A2-
(1)某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是__________。
A.c(H+)·c(OH-)=l.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol·L-1
(2)己知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
(1)该废水中加入绿矾和H+,发生反应的离子方程式为________________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
B.FeS2 ![]() SO2
SO2 ![]() H2SO4
H2SO4
C.N2 ![]() NH3
NH3 ![]() NH4Cl(aq)
NH4Cl(aq)
D.MgCO3 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘微溶于水,易溶于四氯化碳和酒精且碘易升华。现要将碘水中的碘分离出来,下列说法合理的是
A.碘易升华,可采用加热的方法将碘从溶液中升华出来
B.碘易溶于四氯化碳和酒精,所以可选用两种试剂中的任意一种进行萃取
C.四氯化碳比水重,酒精比水轻,所以用四氯化碳进行萃取比用酒精好
D.四氯化碳不溶于水,酒精溶于水,所以用四氯化碳萃取,不能用酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol有机物和0.55 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻4.8 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加26.4 g。
(1)燃烧后产生CO的物质的量___________mol。
(2)该有机物的分子式_____________。
(3)若该有机物能与碳酸钠反应,试写出该有机物的结构简式___________。
(4)若该有机物呈中性且能水解,也能发生银镜反应。名称为____________。
(5)能发生银镜反应,又能与金属钠产生氢气,则同分异构体共有______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com