
 4Na2CrO4+4CO2,
4Na2CrO4+4CO2, 4Na2CrO4+4CO2;
4Na2CrO4+4CO2;

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
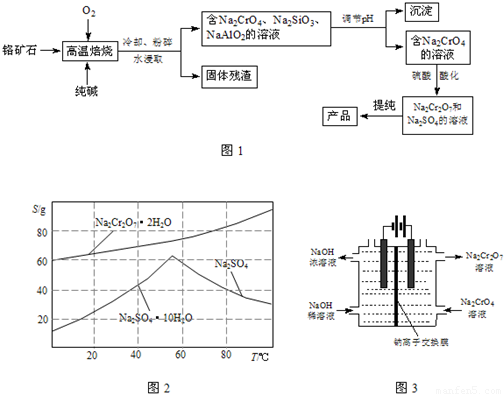
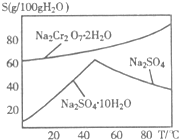 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
| ||
. |
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
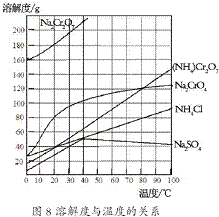 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
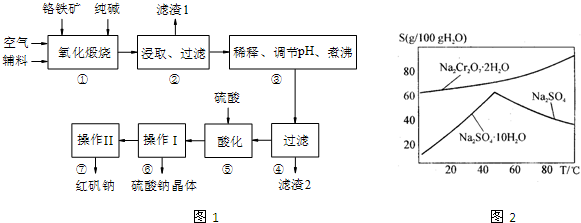
| ||
| A、反应①和②均为氧化还原反应 |
| B、反应①的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性大于Fe3O3小于NaCrO4. |
| D、生成1mol的Na2Cr2O7时整个反应过程共转移6mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com