
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:As3->S2->C1- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
分析 As、Br属于同一周期元素,As位于第VA族、Br位于第VIIA族,
A.电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其气态氢化物的稳定性越强;
C.元素的非金属性越强,其简单阴离子的还原性越弱;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:As、Br属于同一周期元素,As位于第VA族、Br位于第VIIA族,
A.电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小,所以原子半径:As>P>Cl,故A错误;
B.元素的非金属性越强,其气态氢化物的稳定性越强,非金属性Cl>Br>As,所以气态氢化物的稳定性:HCl>HBr>AsH3,故B错误;
C.元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>S>As,则简单阴离子的还原性As3->S2->Cl-,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>P>As,所以酸性:H2SO4>H3PO4>H3AsO4,故D错误;
故选C.
点评 本题考查同一周期、同一主族元素性质递变规律,题目难度不大,明确元素非金属性与其简单阴离子的还原性、最高价氧化物的水化物酸性、气态氢化物的稳定性之间关系即可解答.


科目:高中化学 来源: 题型:解答题

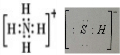 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
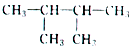 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据 | |
| B. | 升高温度或加入催化剂,不能改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 物质发生化学变化不一定伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
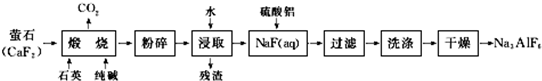
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
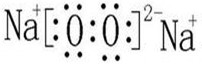 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 品红溶液褪色 | B. | 溴水橙色褪去 | ||
| C. | 含酚酞的NaOH溶液红色变浅 | D. | 紫色石蕊溶液先变红后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com