
【题目】下列说法正确的是
A.P4和CH4的空间构型和键角都相同
B.O3与OF2都是V形分子
C.SO3和SeO32-的立体构型都是三角锥形
D.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
【答案】B
【解析】
试题分析:A.P4与CH4都是正四面体结构,键角分别为60℃、109°28′,两者不同,故A错误;B.O3中O原子形成2个σ键,孤对电子数为![]() (6-2×2)=1,所以立体构型为V型,OF2中O原子的价层电子对数为2+
(6-2×2)=1,所以立体构型为V型,OF2中O原子的价层电子对数为2+![]() (6-2×1)=4,含有2个孤电子对,分子结构属于V形,故B正确;C.在SO3分子中,硫原子周围的价电子对数为3+
(6-2×1)=4,含有2个孤电子对,分子结构属于V形,故B正确;C.在SO3分子中,硫原子周围的价电子对数为3+![]() (6-3×2)=3,所以SO3的立体构型为平面三角形,在SeO32-的中硒原子周围的价电子对数为3+
(6-3×2)=3,所以SO3的立体构型为平面三角形,在SeO32-的中硒原子周围的价电子对数为3+![]() (6+2-3×2)=4,所以SeO32-的立体构型为三角锥形,故C错误;D.CH3CHClCH2CH3是手性分子,HOCH2CH(OH)CH2OH不是手性分子,故D错误;故选B。
(6+2-3×2)=4,所以SeO32-的立体构型为三角锥形,故C错误;D.CH3CHClCH2CH3是手性分子,HOCH2CH(OH)CH2OH不是手性分子,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_____________,CO有多种等电子体,其中常见的一种分子是__________。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____个δ键,C原子的杂化方式为__________。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是__________,形成的化学键是___________。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
写出A原子的电子排布图_______________,Al原子的第一电离能_____(填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填写下列空白。
(1)实验室制取CO2的离子反应方程式:________________________________________;
(2)氢氧化钡和硫酸镁溶液混合反应的离子方程式:_______________________________;
(3)氢氧化铁胶体制备的离子反应:_____________________________________________;
(4)同温同压条件下,等质量的CO和CO2的密度比为:__________。
(5)在NaH+H2O=NaOH+H2↑中,还原剂为________,生成1molH2时转移电子为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代科学的发展使游离态的氮家庭又添新丁,据报道:意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A. N4属于一种新型的化合物 B. N4和N2互为同位素
C. N4与N2互为同素异形体 D. 1molN4气体转变为N2将吸收882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:______________。
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是____________。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有____ mol配位键。
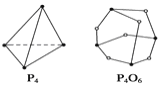
(5)化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498,则反应P4(白磷)+3O2===P4O6的反应热ΔH为______。
(6)写出二氧化硫中的S原子和水合氢离子中O原子分别采用______和______杂化形式,二氧化硫分子和水合氢离子其空间构型分别为________和__________。
(7)HF水溶液中含有的氢键共_______________种。
(8)无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
CoCl2+xH2O = CoCl2·xH2O
深蓝色 粉红色
现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(CoCl2的相对分子质量:131)
①水合物中x=________。
②若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1∶1,则其化学式可表示为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。_____________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___________。其中氮元素原子最外层电子排布的轨道表达式是_____________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是_______。醋酸二氨合铜中铜的配位数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 5LCH4气体与5LNH3气体的原子个数之比为5:4
B. 常温常压下,11.2LO3中所含氧原子个数小于1.5NA
C. 同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度
D. 同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com