
【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合成气用途非常广泛,可以煤、天然气等为原料生产。回答下列问题:
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) H=+ 206 kJ●mol -1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) H=-36 kJ●mol-1
①2H2(g)+O2(g)=2H2O(g)的 H=_______kJ●mol-1。
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :____(保留两位小数)。
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向_____(填“A"或“B’)极迁移;阳极发生的电极反应为___________。
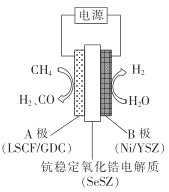
(2)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应( I )、(II )的lgKp(Kp为以分压表示的平衡常数)与T的关系如下图所示。
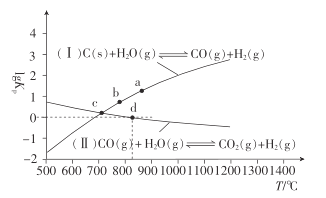
①反应(II)的H_____(填“大于”“等于”或“小于”)0。
②气体的总压强:a点_____ (填“大于”“等 于”或“小于”)b点,理由是_________。
③c点时,反应C(s) +CO2(g)![]() 2CO(g)的Kp=_____ (填数值)。
2CO(g)的Kp=_____ (填数值)。
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为_______;达到平衡时,向容器中再充入0.5 mol CO、2 mol H2O(g),重新达到平衡时,CO的平衡转化率_______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可采用电化学方法除去代谢产物中的尿素,其原理如图所示。
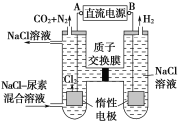
(1)电源的负极为__(填“A”或“B”)。
(2)阳极室中发生的反应依次为__、__。
(3)电解结束后,阴极室中溶液的pH与电解前相比将__(填“升高”“降低”或“不变”);若两极共收集到气体13.44L(标准状况下),则除去的尿素为__g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
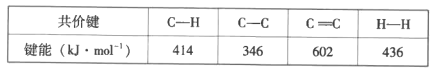
(1)制备丙烯反应的△H=__。该反应在__(“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__(填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)![]() 2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
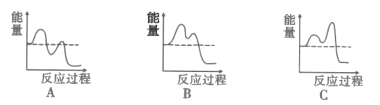
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2![]() CH
CH![]() CH2]+H 慢 H>0
CH2]+H 慢 H>0
[CH2![]() CH
CH![]() CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
如图能表示反应历程的是__(填序号)。.
(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
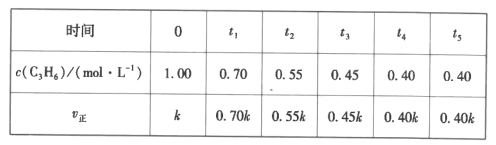
①判断t4时刻反应是否已经达到平衡状态并说明理由:__。
②列式并计算制备丙烯腈反应的平衡常数K=__(mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原石膏的过程会发生多个反应,其中主要反应为Ⅰ、Ⅱ、Ⅲ,当CaSO4(s)与H2(g)的起始物质的量之比为1∶1时,测得平衡时物质的量如图所示。
Ⅰ:CaSO4(s)+H2(g)![]() CaO(s)+H2O(g)+SO2(g) ΔH1>0
CaO(s)+H2O(g)+SO2(g) ΔH1>0
Ⅱ:CaSO4(s)+4H2(g)![]() CaS(s)+4H2O(g) ΔH2<0
CaS(s)+4H2O(g) ΔH2<0
Ⅲ:3CaSO4(s)+CaS(s)![]() 4CaO(s)+4SO2(g) ΔH3
4CaO(s)+4SO2(g) ΔH3
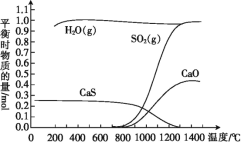
回答下列问题:
(1)100 ℃~700 ℃主要发生反应____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)ΔH3=____(用含ΔH1、ΔH2的代数式表示),ΔH3____(填“>”或“<”)0,反应Ⅲ达到平衡后,升高温度,平衡____(填“正向”或“逆向”)移动。
(3)向某恒温恒容密闭容器中加入0.3 mol CaSO4和0.1 mol CaS,高温下若只发生反应Ⅲ,达到平衡时向容器中再充入少量SO2,下列说法正确的是____(填字母)。
A.重新平衡时,容器内气体总压强增大
B.重新平衡时,CaO的量减少
C.重新平衡时,SO2的浓度不变
D.CaSO4(s)、CaS(s)的质量不变
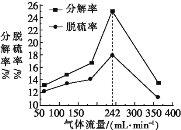
(4)其他条件一定时,H2的流量与石膏的分解率和脱硫率关系如图所示。在气体流量高于242 mL·min-1时,分解率和脱硫率均降低,可能的原因是____(只写一条)。
(5)已知其中副反应之一为2CaSO4(s)![]() 2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,
2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,![]() ≈3.81)。该温度下,反应CaO(s)+SO2(g)+
≈3.81)。该温度下,反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=____(保留整数部分)。
CaSO4(s)的K'p=____(保留整数部分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
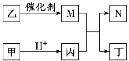
A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com