
 a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1| A.N2H4的燃烧热大于534 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量 |
科目:高中化学 来源:不详 题型:单选题
| A.9:1 | B.1:9 | C.101:99 | D.99:101 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++OH— △H>0,下列叙述正确的是( )
H++OH— △H>0,下列叙述正确的是( )| A.向水中加入稀氨水,平衡逆向移动,c(OH—)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体NaOH,平衡逆向移动,c(OH—)降低 |
| D.将水加热,Kw增大,c(H+)不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
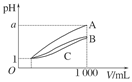
| 序号 | Ba(OH)2溶液体积/mL | 盐酸体积/mL | 混合液pH |
| 1 | 22.00 | 0 | 10 |
| 2 | 22.00 | 18.00 | 9 |
| 3 | 22.00 | 22.00 | 8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知:正丁烷稳定性小于异丁烷,则CH3CH2CH2CH3(g)→(CH3)2CHCH3(g);△H>0 |
B.已知: OH-(ag)+H+(aq)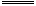 H2O(l);△H="-57.4" kJ/mol H2O(l);△H="-57.4" kJ/mol 则含20.0g NaOH的稀溶液与稀醋酸完全中和,放出28.7kJ的热量; |
C.已知:2H2O(l) 2H2(g)+O2(g);△H=" +483.6" kJ· mol—1,则氢气的燃烧热为241.8kJ/mol 2H2(g)+O2(g);△H=" +483.6" kJ· mol—1,则氢气的燃烧热为241.8kJ/mol |
| D.己知:2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 ________25 ℃。
________25 ℃。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com