
【题目】一定条件下,在体积为10L的密闭容器中,1molA和1molB进行反应:2A(g)+B(g)![]() 2C(g),达到平衡时生成0.6molC。下列说法正确的是( )
2C(g),达到平衡时生成0.6molC。下列说法正确的是( )
A.当容器内密度保持不变时,可以判断反应已达到平衡
B.其他条件不变,将容器体积变为5L,C的平衡浓度变为原来的2倍
C.达到平衡时,C的体积百分含量为0.353
D.其他条件不变,若增大压强,则物质A的转化率减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
(1)该反应中被氧化是元素是_________;写出该反应的平衡常数表达式:K=_________。增大NO2浓度,平衡常数K_________。(填“增大”、“减小”或“不变”)
(2)若上述反应在密闭容器中进行,能表明反应达到平衡状态的是_________(选填编号)。
a. 混合气体颜色保持不变 b. NO2和NO的体积比保持不变
c. 每消耗1 mol SO2的同时生成1 mol SO3 d. 体系中气体平均摩尔质量保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO2)=_________(用相关字母表示)。
(4)请写出两种能提高平衡转化率的措施____________、______________。
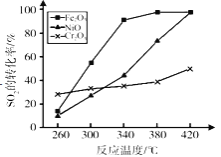
(5)其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选择Fe2O3作催化剂的主要原因是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
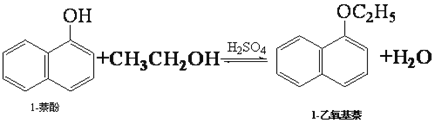
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
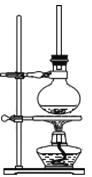
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是________。
(2)装置中长玻璃管的作用是:______________。
(3)该反应能否用实验室制备乙酸乙酯的装置_____(选填“能”或“不能”),简述理由_____________。
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是____________(选填编号)。
a.③②④① b.①②③④ c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是____________。

(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,生产工艺如下:
![]()
完成下列填空:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],反应的化学方程式为___。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:Mg(OH)2-xClxmH2O→(1-![]() )Mg(OH)2+
)Mg(OH)2+![]() MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是___。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJmol-1
Al(OH)3(s)→![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g)-87.7kJmol-1
H2O(g)-87.7kJmol-1
Mg(OH)2和Al(OH)3起阻燃作用的主要原因是___。等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是___,原因是___。
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程(框内写产物名称,箭头上标明转化条件):___
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A. B.
B.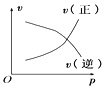 C.
C.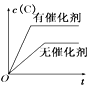 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料,已知25℃,101KPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) △H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为___。
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH__7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,c(OH-)=__。
(3)向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为___、___(填“减小”“增大”或“不变”)。
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴离子总浓度大小为c(NaA)__c(NaB)(填“>”、“<”或“=“)。
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+恰好完全沉淀的pH为__。(已知:当离子浓度小于或等于10-5mol/L认为完全反应;Ksp[Fe(OH)3]=8×10-38,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,密闭容器中发生反应Mg)N(g),反应过程中的能量变化如图中曲线所示,下列说法错误的是

A.该反应正反应活化能为E3-E2
B.该反应的△H=E1-E2
C.曲线Ⅱ表示其他条件不变,升高温度时的能量变化
D.曲线Ⅲ表示其他条件不变,加入催化剂时的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是

A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是
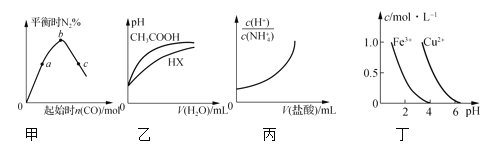
A.图甲表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
B.图乙表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
C.图丙表示25℃时,向0.1 mol·L-1NH4Cl溶液中滴加0.1 mol·L-1盐酸,溶液随盐酸体积的变化关系
D.根据图丁,若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com