
【题目】溶液的酸碱性可用酸度![]() 表示,AG=lg
表示,AG=lg 。室温下,将
。室温下,将![]() 盐酸逐滴滴人
盐酸逐滴滴人![]()
![]()
![]() 氨水中,溶液的AG变化如图所示。下列说法正确的是( )
氨水中,溶液的AG变化如图所示。下列说法正确的是( )
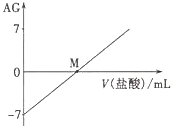
A.室温下,![]()
![]() 盐酸的
盐酸的![]()
B.M点时溶液中:![]()
C.M点加入盐酸的体积大于![]() mL
mL
D.M点以后NH4+的水解程度逐渐增大
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是


A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:![]() 石墨
石墨![]()
![]()
![]() 石墨
石墨![]()
则4Fe![]() ______
______
(2)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图1所示:用Z表示的反应速率为______![]() ,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。
,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。

(3)图2为乙烷![]() 燃料电池的装置
燃料电池的装置![]() 、B为多孔碳棒
、B为多孔碳棒![]() :______
:______![]() 填A或
填A或![]() 处电极入口通乙烷,其电极反应式为______。
处电极入口通乙烷,其电极反应式为______。
(4)用中和滴定法测定溶液碱溶液的浓度。
①滴定时,用![]() 的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
②下列操作![]() 其他操作正确
其他操作正确![]() 造成测定结果偏低是______
造成测定结果偏低是______
A.滴定终点读数时俯视读数
B.酸式滴定管使用前水洗后未用标准盐酸溶液润洗
C.锥形瓶水洗用待测液润洗
D.酸式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活和社会密切相关。下列有关说法不正确的是![]()
A.发展“低碳经济”能够减少对化石能源的依赖
B.明矾溶于水会生成氢氧化铝胶体,故可用明矾作净水剂
C.铁制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀
D.处理含![]() 的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是_____。
A 质谱法 B 原子发射光谱法 C 核磁共振谱法 D X射线行射法
(2)第一电离能介于Al、P之间的第三周期元素有___种。GaCl3分子中心原子的杂化方式为___。
(3)基态As原子的核外电子排布式为_____,As原子的逐级电离能数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
为什么第五电离能与第六电离能相差较大_____________。
(4)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。

(5)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为_____,层与层之间的相互作用为_____。

(6)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为_____,每个As原子周围最近的As原子数目为_____,一个GaAs晶胞中配位键的数目为_____。

(7)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为_____ nm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com