
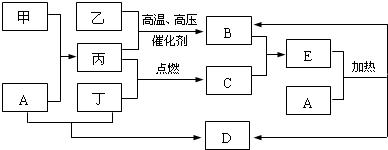
 ;
;分析 乙、丙为单质,在高温高压下催化生成B,且B与C相遇生成大量白烟,可知B为NH3,C为HCl,由转化关系可知丙为H2,乙为N2,E为NH4Cl,则丁为Cl2,D是日常生活中常见的盐,为NaCl,A与E反应可生成氨气,则A应为NaOH,金属甲可与NaOH反应生成H2,则甲为Al,结合对应物质的性质以及题目要求可解答该题.
解答 解:乙、丙为单质,在高温高压下催化生成B,且B与C相遇生成大量白烟,可知B为NH3,C为HCl,由转化关系可知丙为H2,乙为N2,E为NH4Cl,则丁为Cl2,D是日常生活中常见的盐,为NaCl,A与E反应可生成氨气,则A应为NaOH,金属甲可与NaOH反应生成H2,则甲为Al,
(1)由以上分析可知甲为Al,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(2)B为NH3,为共价化合物,分子中含有3个N-H键,其电子式为 ,
,
故答案为: ;
;
(3)甲为Al,A溶液为氢氧化钠,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)NaOH和NH4Cl在加热条件下反应生成氨气,反应的方程式为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+NaCl+H2O,
故答案为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+NaCl+H2O.
点评 本题考查无机物的推断,题目难度中等,明确常见物质的性质为解答关键,该题的突破口为物质的颜色、含量以及物质之间的转化关系,试题培养了学生的分析、理解能力及逻辑推理能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漂白粉可以净化饮用水 | |
| B. | 铜的金属性比铁弱,所以可用铜罐代替铁罐贮藏浓硝酸 | |
| C. | 合成纤维和光导纤维都是人工合成的有机高分子化合物 | |
| D. | 工业上可用石灰乳对煤燃烧形成的烟气进行脱硫,最终能制得石膏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.533L | B. | 0.267L | C. | 4.0L | D. | 2.0L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com