
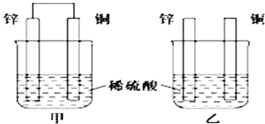
分析 ①甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②作原电池负极的金属加速被腐蚀;
③原电池工作时,阴离子向负极移动;
④根据氢气和转移电子之间的关系式计算.
解答 解:①A.甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故A错误;
B.乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B正确;
C.甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故C错误;
D.两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,所以溶液的pH均增大,故D正确;
故答案为:BD;
②甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
③锌为负极,硫酸根离子向锌极移动过,负极电极反应式为:Zn-2e-=Zn2+,故答案为:锌;Zn-2e-=Zn2+;
④甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=$\frac{1.12L}{22.4L/mol}$×2=0.1mol,通过导线的电子数目为0.1NA或6.02×1022,
故答案为:0.1NA或6.02×1022.
点评 本题考查原电池设计,侧重考查学生设计及计算能力,会根据得失电子确定原电池正负极、电解质溶液,失电子的金属作负极、得电子的可溶性电解质溶液为该原电池电解质溶液,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氮气所含的原子数为NA | |
| B. | 1mol硫与铁充分反应转移的电子数为2NA | |
| C. | 常温常压下,48gSO3含有的分子数为3NA | |
| D. | 常温常压下,1molNO2气体与水反应生成NA个NO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度相等 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.75mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=1.0mol/(L•s) | D. | v(D)=0.8mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mol氧约含有6.02×1024个氧分子 | |
| B. | NA 约等于6.02×1023 | |
| C. | 摩尔是国际科学界广泛使用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com