
【题目】如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( ) 
A.原子半径:Z>W>X>Y
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值不可能相等
D.Z的最高价氧化物的水化物可能为强碱
【答案】A
【解析】解:如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期,
A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径大小为:Z>W>X>Y,故A正确;
B.同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,且元素的非金属性越强,对应氢化物的稳定性越大,则气态氢化物的稳定性:Y>X>W>Z,故B错误;
C.如W为Si,则四种元素分别为C、N、Al、Si,W的最高正化合价与负化合价的绝对值相等,故C错误;
D.Z的最高价氧化物的水化物可能为:Al(OH)3、H2SiO3、H3PO4 , 则Z的最高价氧化物的水化物为弱碱或弱酸,故D错误;
故选A.
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期,
A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
B.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
C.W处于第三周期,可能处于ⅣA族或ⅤA或ⅥA族,最高正价=族序数,最低负化合价=族序数﹣8;
D.Z至少处于ⅢA族,氢氧化铝为弱碱.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】把5.1g镁铝合金的粉末放入过量的300mL 2molL﹣1盐酸中,得到5.6L H2(标准状况下).试计算:
(1)该合金中铝和镁的物质的量之比.
(2)在反应后的溶液中加入4molL﹣1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A. 乙烯在空气中燃烧 B. 乙烯在一定条件下跟HCl反应
C. 苯与液溴在FeBr3催化下生成溴苯 D. 苯在一定条件下跟H2反应生成环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
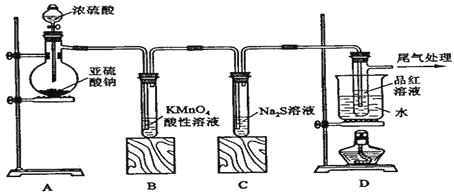
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取漂白粉的化学方程式是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,该反应的氧化剂与还原剂之比为
A.1:2 B.2:1 C.1:1 D.3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com