
【题目】已知: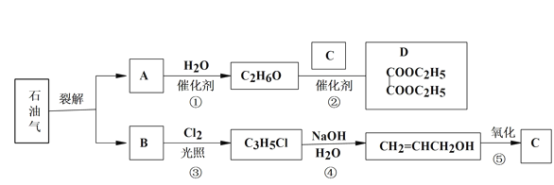
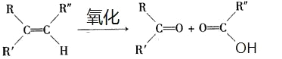
(1)B 和 A 为同系物,B 的结构简式为_____,其含有的官能团名称为_____。
(2)反应①的化学方程式为_____,其反应类型为_____。
(3)写出检验 C3H5Cl 中含有 Cl 原子的方法_____。
(4)C 的结构简式为________。
(5)反应④的化学方程式为________。
(6) 设计一条由乙烯为原料制备 D 的合成路线(其他无机原料任选)。合成路线流程图示例如下:_____
【答案】CH2=CHCH3碳碳双键CH2=CH2+H2O ![]() CH3CH2OH加成反应加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl 原子。HOOC—COOHCH2=CHCH2Cl+NaOH
CH3CH2OH加成反应加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl 原子。HOOC—COOHCH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH +NaCl
CH2=CHCH2OH +NaCl
【解析】
由于B与氯气反应产物为C3H5Cl,该反应为取代反应,故B分子式为C3H6,可知B中含有一个不饱和键,根据分子式可推知B为丙烯,A与B为同系物,发生加成以后分子式为C2H6O,故A为乙烯,C为HOOC—COOH;
(1)由于B与氯气反应产物为C3H5Cl,该反应为取代反应,故B分子式为C3H6,可知B中含有一个不饱和键,根据分子式可推知B为丙烯,含有官能团为碳碳双键;
(2)A与B为同系物,发生加成以后分子式为C2H6O,故为乙烯,化学方程式为:![]() ;其反应类型为加成反应;
;其反应类型为加成反应;
(3)写出检验 C3H5Cl 中含有 Cl 原子的方法:加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl 原子。
(4)C 的结构简式为HOOC—COOH ;
(5)反应④的化学方程式为CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH +NaCl;
CH2=CHCH2OH +NaCl;
(6) 设计一条由乙烯为原料制备 D 的合成路线 。
。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】将足量的O2和NH3混合成448 mL,通过预先加热的催化剂三氧化二铬充分反应后,再通过足量的水,最终收集到44.8mL的无色气体。则原混合气体中O2的体积可能是(氨全部被氧化;气体体积均已换算成标准状况)( )
A. 231.5 mLB. 268.8 mLC. 287.5 mLD. 56 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中表达正确的是( )
A. 第VⅡA族元素形成的氢化物中沸点最高的是HI
B. 水分子很稳定性是因为水分子间易形成氢键
C. 用电子式表示HCl形成过程:![]()
D. 第三周期元素形成的简单离子中,半径最小的是Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________;写出相关化学离子方程式:_____________、______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
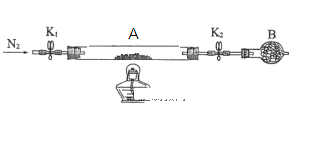
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
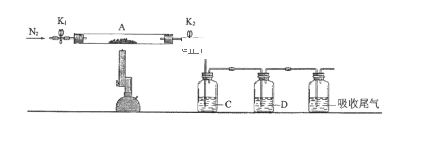
C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式:_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

下列说法不正确的是
A. 聚氯乙烯的单体可由乙烯与HCl加成而得
B. 上述反应中①属于消去反应,④属于(脱氢)氧化反应
C. 火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D. 在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,遇到盐酸或强碱溶液都能反应的一组是
A.Cu Al2O3NaHCO3B.Mg Al(OH)3Na2CO3
C.Fe Al2O3Al(OH)3D.Al NaHCO3Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氯元素的非金属性比硫元素强的事实是( )
A. Cl2与H2S溶液发生置换反应
B. 受热时H2S能分解,HCl则不能
C. 硫和Cl2分别与氢气化合时, Cl2比硫更容易
D. 溶于水时HCl是强酸,H2S是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Licht等科学家设计的Al—MnO4—电池原理如图所示,电池总反应为Al+MnO4—===AlO2—+MnO2,下列说法正确的是( )
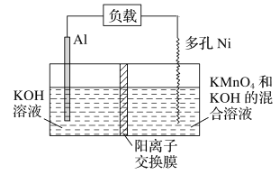
A. 电池工作时,K+向负极区移动
B. Al电极发生还原反应
C. 正极的电极反应式为MnO4—+4H++3e-===MnO2+2H2O
D. 理论上电路中每通过1mol电子,负极质量减小9g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com