
| A. | 金属甲比金属乙容易失去电子,则甲比乙金属性强 | |
| B. | NaHCO3与NaOH反应有CO2生成 | |
| C. | 稀硝酸能将亚铁离子氧化为铁离子 | |
| D. | Na2CO3不能用于治疗胃酸过多 |
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等物质的量的二氧化硫和一氧化碳所含的分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
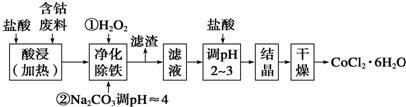
| 物质 | 溶度积Ksp | 沉淀完全时的pH |
| Co(OH)2 | 5.9×10-15 | 9.4 |
| Fe(OH)2 | 1.6×10-14 | 9.6 |
| Fe(OH)3 | 1.1×10-36 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
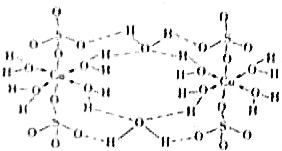 下列说法正确的是( )
下列说法正确的是( )| A. | 在如图结构示意图中,所有氧原子都采用sp3杂化 | |
| B. | 在如图结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内消耗amolA和同时生成3amolC | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
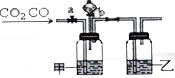 某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).
某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水:K+、Na+、Cl-、HSO3- | |
| C. | pH=13溶液:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L KNO3溶液:H+、Fe2+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于30mL | B. | 等于30mL | C. | 大于20mL | D. | 等于20mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com