
| A. | 相对分子质量M=$\frac{22.4mw}{(1-w)V}$ | B. | 物质的量浓度c=$\frac{1000ρv}{Mv+22.4}$ | ||
| C. | 质量分数w=$\frac{Mv}{22.4m}$ | D. | 溶液密度ρ=$\frac{cM}{1000w}$ |
分析 A.先根据n=$\frac{V}{{V}_{m}}$计算出该气体的物质的量,再结合水的质量、溶质质量分数计算出溶液中含有该气体质量,最后根据M=$\frac{m}{n}$计算出其摩尔质量;
B.先根据m=nM计算出该气体得到质量,从而可知所得溶液质量,然后根据V=$\frac{m}{ρ}$计算出溶液体积,最后根据c=$\frac{n}{V}$计算出该溶液的浓度c;
C.根据溶质质量分数w=$\frac{{m}_{溶质}}{{m}_{溶液}}$计算;
D.设溶液体积为xcm-3,根据密度ρ=$\frac{{m}_{溶液}}{V}$计算.
解答 解:A.标准状况下vL 气体的物质的量为:$\frac{vL}{22.4L/mol}$=$\frac{v}{22.4}$mol,水的质量分数为1-w,该溶液中含有该气体的质量为:$\frac{mg}{(1-w)}$×w=$\frac{mw}{1-w}$g,则该气体的摩尔质量为:M=$\frac{\frac{mw}{1-w}g}{\frac{v}{22.4}mol}$=$\frac{22.4mw}{(1-w)V}$g/mol,该气体的相对分子质量为$\frac{22.4mw}{(1-w)V}$,故A正确;
B.该气体的物质的量为$\frac{v}{22.4}$mol,该气体质量为:$\frac{v}{22.4}$mol×Mg/mol=$\frac{Mv}{22.4}$g,所得溶液质量为:mg+$\frac{Mv}{22.4}$g,所得溶液的体积为:$\frac{(m+\frac{Mv}{22.4})g}{1000ρg/L}$=$\frac{22.4m+Mv}{22400ρ}$L,则该溶液的物质的量浓度为:c=$\frac{\frac{v}{22.4}mol}{\frac{22.4m+Mv}{22400ρ}}$=$\frac{1000ρv}{Mv+22.4m}$mol/L,故B错误;
C.该气体质量为$\frac{Mv}{22.4}$g,所得溶液质量为(m+$\frac{Mv}{22.4}$)g,该溶液的质量分数为w=$\frac{\frac{Mv}{22.4}g}{(m+\frac{Mv}{22.4})g}$=$\frac{Mv}{22.4m+Mv}$,故C错误;
D.设溶液体积为xcm-3,该溶液中含有溶质的质量为:Mg/mol×cmol/L×x×10-3L=cMx×10-3g,该溶液质量为:$\frac{cMx×1{0}^{-3}g}{w}$,该溶液的密度为:ρ=$\frac{\frac{cMx×1{0}^{-3}}{w}}{x}$g•cm-3=$\frac{cM}{1000w}$g•cm-3,故D正确;
故选BC.
点评 本题考查了物质的量与气体摩尔体积、物质的量浓度等之间的综合应用,题目难度中等,明确物质的量与其它物理量之间的转化关系为解答关键,试题培养了学生的分析能力及化学计算能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:实验题
 苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下:
苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下: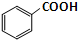 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 物质 | 颜色状态 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
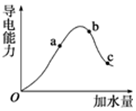 一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
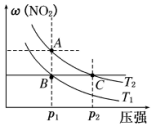 反应 N2O4(g)?2NO2(g)在温度为 T1、T2(T2>T1)时,平衡体系中 NO2的体积分数随压强变化如图所示.下列说法正 确的是( )
反应 N2O4(g)?2NO2(g)在温度为 T1、T2(T2>T1)时,平衡体系中 NO2的体积分数随压强变化如图所示.下列说法正 确的是( )| A. | 由图可知 B 点的平衡常数大于 C 点的平衡常数 | |
| B. | A、C 两点气体的颜色:A 深,C 浅 | |
| C. | A、C 两点气体的平均相对分子质量:A<C | |
| D. | 保持容器体积不变,再充入 N2O4 气体,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、Fe3+、OH-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Ca2+、Mg2+、HCO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列反应中,属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.CaO+H2O=Ca(OH)2
C.CaCO3=CaO+CO2↑
D.2H2O2=2H2O+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com