
��1 L��Һ�к���Fe(NO3)3��H2SO4�������ʣ���Ũ�ȷֱ�Ϊ0.2 mol•L-1��1.5 mol•L-1���������Һ�м���39.2 g����ʹ���ַ�Ӧ�������й�˵����ȷ����
A����Ӧ����Һ��Fe3+���ʵ���Ϊ0.8 mol
B����Ӧ�����13.44 L H2����״����
C����Ӧ����Һ��Fe2����Fe3�����ʵ���֮��Ϊ0.9 mol
D������������Fe3+>H+���ʷ�Ӧ����û������������������
C
��������
�����������1 L��Һ�к���Fe(NO3)3��H2SO4�������ʣ���Ũ�ȷֱ�Ϊ0.2 mol•L-1��1.5 mol•L-1 n(Fe(NO3)3)=0.2mol;n(H2SO4)=1.5mol.n(Fe)=39.2g��56g/mol=0.7mol.��Һ�и����ӵ����ʵ���Ϊn(Fe3+)= 0.2mol;n(NO3-)=0.6mol;n(H+)=3mol;n(SO42-)=1.5mol .��ʼ������Ӧ��Fe+4H++NO3-= Fe3++NO��+ 2H2O.���ݸ������������ʵ����Ķ��ٿ�֪Ӧ�ð���NO3-�����м��㡣����Fe��0.6mol,����H+2.4mol,����ʣ���������0.6mol.����NO����0.6mol.��ʱ��Һ�к���Fe3+�����ʵ���Ϊ0.7mol.ʣ�����۷�����Ӧ��Fe+2Fe3+=3Fe2+.��Ϊ����������0.1mol��Fe3+0.8mol���ݶ��߹�ϵ��֪������ȫ��Ӧ����0.3mol Fe2+������Fe3+0.6mol.����ڷ�Ӧ�����Һ�е�Fe2����Fe3�����ʵ���֮��Ϊ0.9 mol ��A����C��ȷ�� ����NO��������ʵ���Ϊ0.6mol.���ڱ�״�������Ϊ0.6mol��22.4l/mol=13.44L. B�����ڷ�Ӧ�Ĺ�����ʼ�������������D����
���㣺������Fe(NO3)3��H2SO4�Ļ����Һ�м���Fe�۷����ķ�Ӧ��ǰ��˳���֪ʶ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
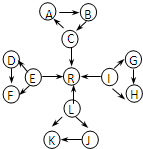 Ԫ�ؼ��仯��������ѧ��ѧ������֪ʶ������������Ԫ�ػ�����֮����ת��ʱ��������Щ���ʼ������ͼ��ʾ������ת����ϵ�����ַ�Ӧ�������������ȥ����
Ԫ�ؼ��仯��������ѧ��ѧ������֪ʶ������������Ԫ�ػ�����֮����ת��ʱ��������Щ���ʼ������ͼ��ʾ������ת����ϵ�����ַ�Ӧ�������������ȥ����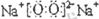
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
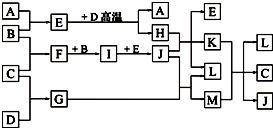 ��ͼ�������µ���A��BΪ���壬����CΪ���壬�������ηֱ��ɶ�����Ԫ�ؼס��ҡ�����ɣ���Ԫ��ԭ�Ӻ����������������Ӳ������ҡ���ͬ���壻E������ΪҺ�壬G��HΪ��ɫ���壬D�dz�����������Ӧ����������ȥ����
��ͼ�������µ���A��BΪ���壬����CΪ���壬�������ηֱ��ɶ�����Ԫ�ؼס��ҡ�����ɣ���Ԫ��ԭ�Ӻ����������������Ӳ������ҡ���ͬ���壻E������ΪҺ�壬G��HΪ��ɫ���壬D�dz�����������Ӧ����������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ�ع��и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
NA���������ӵ�����������������ȷ����
A��1 mol Cl2����ˮ�Ĺ�������2NA������ת��
B����1 L 0.1 mol��L��1��������Һ�к���F����ĿΪNA
C��1 mol�״��к���C��H������ĿΪ3NA
D��10 L pH��1��������Һ�к��е�H����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ��У�����߶����ϣ����л�ѧ�Ծ��������棩 ���ͣ������
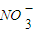
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com