
分析 (1)配制500mL一定物质的量浓度的溶液所需主要仪器是500mL容量瓶、量筒、烧杯、玻璃棒、胶头滴管;
(2)量取15.00mL待测的碱性溶液应选用碱式滴定管;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)滴定过程中溶液从碱性溶液向中性过渡,溶液里的溶质从NaOH到NaCl、NaOH过渡,最后呈中性是溶质为NaCl,但溶液始终显中性,存在电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(Cl-),据此分析判断.
解答 解:(1)配制500mL溶液需要的主要仪器除500mL容量瓶、量筒、烧杯、玻璃棒外,还有一种必须使用的仪器是定容时要用的胶头滴管,故答案为:胶头滴管;
(2)为精确量取15.00mL待测碱性溶液于锥形瓶中,需要使用碱式滴定管,故答案为:碱式滴定管;
(3)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,故答案为:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)A.若c(Na+)>c(Cl-)>c(H+)>c(OH-)成立,则c(Na+)+c(H+)>c(Cl-)+c(OH-),明显与溶液里存在的电荷守恒式不吻合,故A错误;
B.在NaOH溶液只滴加几滴稀盐酸,此时溶液只生成少量NaCl,应该存在c(Na+)>c(OH-)>c(Cl-)>c(H+),故B正确;
C.溶液始终显中性,存在电荷守恒式c(Na+)+c(H+)=c(OH-)+c(Cl-),故C正确;
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)与溶液里存在的电荷式c(Na+)+c(H+)=c(OH-)+c(Cl-)不符,故D错误;
故选AD.
点评 本题主要考查了酸碱中和滴定实验操作以及滴定过程中溶液里离子浓度大小比较,难度不大,能准确写出溶液里的电荷守恒式是解答关键,结合所学知识即可完成.


科目:高中化学 来源: 题型:选择题
| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 物质 | 试剂或操作名称 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:MgO(Al2O3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:NaCl、KCl | |
| ⑤ | 鉴别:AlCl3、Al2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C7H8O,且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的使酸性KMnO4溶液褪色的气体只是乙烯 | |
| D. | 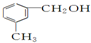 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水:c (Na+)=c(NH4+ ) | |
| C. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c( H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在的离子为Fe3+、SO42- | |
| B. | 一定不存在的离子为CO32-、I- | |
| C. | 不能确定的离子为K+、SO42- | |
| D. | 确定是否含有K+离子需要经过焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 所有化学反应都可以设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com