
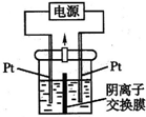
 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )| A、右侧发生的电极方程式:2H2O+2e-=H2↑+2OH- | ||||
| B、电解结束时,右侧溶液中含有IO3- | ||||
C、电解槽内发生反应的总化学方程式KI+3H2O
| ||||
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、常温常压下,17g甲基(-14CH3)所含的中子数为8NA |
| B、64g的铜发生氧化还原反应,一定失去2 NA个电子 |
| C、常温常压22.4LNO气体的分子数为NA |
| D、标况时,22.4L三氯甲烷所含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2a=b |
| B、2b=a |
| C、b>2a |
| D、1/2b<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
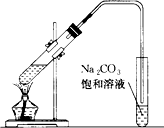 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
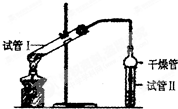 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH| 浓H2SO4 |
| △ |
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 | |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
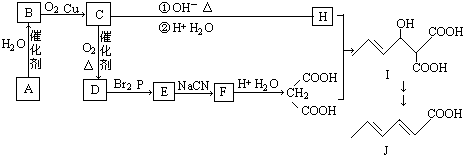
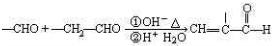
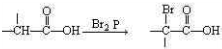
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com