
分析 (1)配制的是浓度约为0.1mol•L-1的NaOH溶液,500mL水的体积近似为溶液的体积;
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小;
(3)在烧杯中稀释后的醋酸溶液需要转移到容量瓶中定容;
(4)碱滴定酸,酚酞作指示剂,开始为无色,滴定终点时变为红色;
(5)滴定终点时,n(CH3COOH)=n(NaOH),以此计算.
解答 解:(1)由于配制的是浓度约为0.1mol•L-1的NaOH溶液,是比较粗略的配制,故该配制步骤是可行的,故答案为:可行;
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,则配制出的溶液的浓度偏小,故答案为:小;
(3)稀释醋酸的操作为:用酸式滴定管量取一定体积的白醋,在烧杯中溶解,用玻璃棒引流注入100mL容量瓶,用胶头滴管定容,故需要的仪器有酸式滴定管、烧杯、玻璃棒、胶头滴管、100mL容量瓶,故答案为:100mL容量瓶;
(4)由于是用碱滴定酸,指示剂是酚酞,故当溶液变成浅红色且30秒内不褪色时达到滴定终点,故答案为:溶液变成浅红色且30秒内不褪色;
(5)稀释后白醋中醋酸的物质的量浓度xmol/L,根据达滴定终点时,n(CH3COOH)=n(NaOH),可有xmol/L×0.02L=cmol•L-1×V×10-3L,解得x=$\frac{cV}{20}$mol/L,
故答案为:$\frac{cV}{20}$.
点评 本题考查物质含量测定,为高频考点,把握滴定原理、实验操作、仪器的使用为解答的关键,侧重分析与实验能力的考查,注意酸碱中和的实质,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
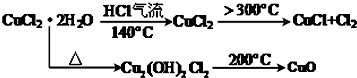
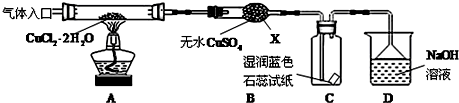
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
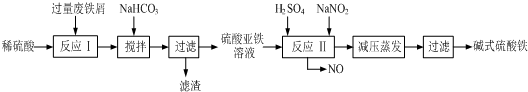
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
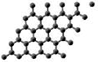
| A. | 石墨烯导电属于化学变化 | B. | 石墨烯与金刚石结构相同 | ||
| C. | 纤维素与淀粉互为同分异构体 | D. | 纤维素属于天然高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com