
| A. | NaHCO3的电离:NaHCO3?Na++H++CO32- | |
| B. | HS-的水解:HS-+H2O?H3O++S2- | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+2H+═I2+2H2O |
分析 A.完全电离生成钠离子和碳酸氢根离子;
B.水解生成氢硫酸和氢氧根离子;
C.燃烧热对应生成稳定氧化物,水应为液态;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.NaHCO3的电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.HS-的水解方程式为HS-+H2O?H2S+OH-,故B错误;
C.甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-890.3kJ•mol-1,故C错误;
D.双氧水中加入稀硫酸和KI溶液的离子反应为H2O2+2I-+2H+═I2+2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握离子反应方程式的书写方法及化学用语的使用为解答的关键,侧重水解、电离、氧化还原反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 实验现象 | 结论 |
| ①用刀切开金属钠,观察切开的金属钠表面 | 切面变暗淡 | 化学方程式为: 4Na+O2═2Na2O |
| ②把一小块钠放在石棉网上加热 | 生成淡黄色的固体 | 化学方程式为: 2Na+O2═Na2O2 |
| ③把一小块金属钠投入滴有酚酞的水中 | 溶液变红色 | 证明有NaOH生成. |
④如图装置收集一试管气体,将试管口向下移近酒精灯火焰  | 听到轻微的“噗”声 | 有氢气生成. 钠与水反应的离子方程式为: 2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与稀硝酸反应:2Fe3O4+18H+═6Fe3++H2↑+ 8H2O | 正确 |
| B | 向碳酸镁中加稀盐酸:CO${\;}_{3}^{2-}$+2H+═CO2↑+ H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+ Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
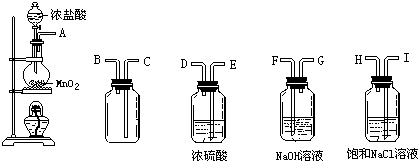
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为工业上氯碱工业的电解槽示意图,据图回答:
如图为工业上氯碱工业的电解槽示意图,据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com