
| A. | 溴蒸汽被木炭吸附 | B. | 烧碱熔化 | ||
| C. | 碳酸钙高温分解 | D. | HCl溶于水 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
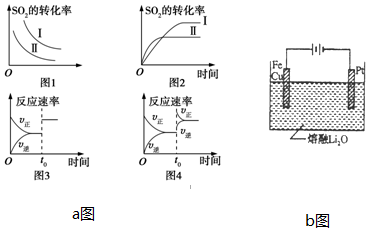
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu做还原剂 | B. | H2做氧化剂 | ||
| C. | 铜元素的化合价降低 | D. | 铜是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
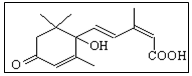 国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A. | 其分子式为C15H18O4 | |
| B. | 分子中存在4种含氧官能团 | |
| C. | 既能发生加聚反应,又能发生缩聚反应 | |
| D. | 1mol该有机物最多可与4molBr2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 非氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com