
分析 电镀利用的是电解原理,将镀件放在阴极,镀层金属离子在阴极得到电子生成镀层金属;阳极用镀层金属,镀层金属在阳极失去电子不断补充电解质溶液中的镀层金属离子;电解质溶液必须使用含有镀层金属离子的溶液.
解答 解:电镀利用的是电解原理,阳极失去电子发生氧化反应,阴极得到电子发生还原反应,所以电镀时,镀件作阴极,电解质溶液中的镀层金属离子得到电子形成镀层;镀层金属作阳极,以便金属补充电解质溶液中减少的镀层金属离子;而电解质溶液为含有镀层金属阳离子的溶液,
故答案为:阴;阳;含有镀层金属阳离子的溶液.
点评 本题考查了电解原理的应用,题目难度不大,明确电解原理为解答关键,注意掌握电镀时阳极、阴极及电解质溶液的选用方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


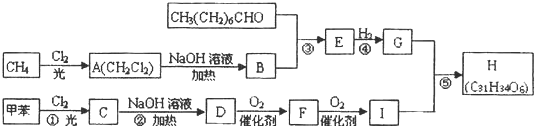
 ,F
,F .
. 、
、 、
、 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、Cl-、CH3COO- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Na+、Cu2+、SO42-、NO3 | D. | NH4+、Na+、CO32-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (H+)<c (OH-) | B. | c (HX )<c (X-) | ||
| C. | c (X-)+c(HX )=2c (Na+) | D. | c (X-)-c (HX)═2(c( OH-)-c (H+)) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=V2 | B. | V1>V2 | C. | V1<V2 | D. | V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com