
【题目】下列变化过程属于化学变化的是
A.碘升华B.氯气用于自来水消毒
C.浓盐酸的挥发D.用苯萃取溴水中的溴
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________;丁装置中稀硫酸的作用是______________。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________管通入 __________气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水):
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________。
(6)根据侯氏制碱原理制备少量NaHCO

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是 ______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,书写正确的是
A.KNO3=K++NO3ˉB.NaHSO4=Na+ +HSO4ˉ
C.Na2SO4=Na2+ +SO42ˉD.KClO3=K++Cl-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应: COS(g)+ H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
己知: 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
写出表示CO燃烧热的热化学方程式:_______________。
(2)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11;草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-5; 0.1mol/LNa2CO3溶液的pH_____0.1mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等分浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是___________。(选填编号)
A.c(H+)>c(HC2O4-)> (HCO3-)>c (CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(3)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10;②25℃时2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体长变化),得到c(HF)、c(F-) 与溶液pH 的变化关系,如图所示:
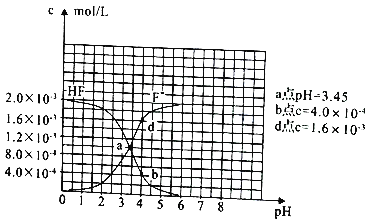
请根据信息回答下列问题:
①25℃时,HF电离平衡常数的数值Ka≈_______。
②4.0×10-3mol/LHF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | 品红溶液中通入足量SO2气体 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 红色褪去 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有的重要性质有酸性、吸水性,脱水性、强氧化性。请把下列现象中浓硫酸表現出来的性质填写在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现________;
(2)盛有浓硫酸的烧杯敞口放置一段时间,质最增加,则浓硫酸表现出________;
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | Cl2有漂白性 | Cl2能使品红溶液褪色 |
C | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com