
| A. | a能将e从其氧化物中置换出来,因此非金属性a>e | |
| B. | b元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| C. | 工业上不用电解氯化物的方法制备单质d是由于其氯化物的熔点高 | |
| D. | 相同质量的c和d单质分别与足量稀盐酸反应,前者生成的氢气多 |
分析 a原子核外最外层电子数是次外层的2倍,应为C元素,c是同周期中原子半径最大的元素,应为Na元素,工业上一般通过电解氧化物的方法制备d的单质,则d为Al,e的单质是制备太阳能电池的重要材料,应为Si元素,b、c、e最外层电子数之和为10,则b的最外层电子数为10-1-4=5,应为N元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知a为C、b为N、c为Na、d为Al、e为Si.
A.a能将e从其氧化物中置换出来,表现还原性,但非金属性C>Si,故A错误;
B.N的非金属性较强,对应的氢化物分子间存在氢键,沸点较高,故B正确;
C.氯化铝为共价化合物,熔融状态下不导电,不能用于冶炼铝,故C错误;
D.如生成1mol氢气,需要钠46g,铝18g,则相同质量的c和d单质分别与足量稀盐酸反应,后者生成的氢气多,故D错误.
故选B.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,侧重考查学生的分析能力,元素的推断是解答的关键,注意把握元素的性质及单质、化合物的性质即可解答,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液,可制得金属镁 | |
| B. | 测定氢氧化钠是离子化合物时,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| C. | 向FeCl3溶液中加入Mg粉,可观察到有气泡产生 | |
| D. | 在某钠盐溶液中加入澄清石灰水,若有白色沉淀生成,则该钠盐一定是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
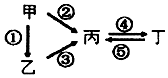 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | S | H2S | SO3 | H2SO4 |
| C | N2 | NH3 | NO | NO2 |
| D | Si | SiO2 | Na2SiO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验 编号 | 温度(K) | 盐酸浓度/ (mol•L-1) | 醋酸浓度/ (mol•L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究温度 对镁与盐酸反应速率的影响; II.实验a和c是探究浓度 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | Na+不断向“水”电池的负极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
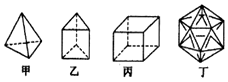
| A. | 1mol甲分子内含有10mol共价键 | B. | 乙分子的一氯取代产物只有一种 | ||
| C. | 丙分子的二氯取代产物只有两种 | D. | 丁分子显然是不可能合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | 碳棒 | Cu | Zn | Mg |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | NaCl | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com