
【题目】下列反应的化学方程式(或离子方程式)错误的是
A. 乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
B. 向Na2CO3溶液中加入过量醋酸溶液:CO32-+2H+=CO2↑+H2O
C. 苯酚与氢氧化钠溶液反应 C6H5OH+OH—→ C6H5O—+H2O
D. 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液:2C1-+2H2O![]() H2↑+Cl2↑+2OH—
H2↑+Cl2↑+2OH—
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F,原子序数依次递增。已知:A、B、D、C的价电子数依次增多,其中C元素的原子半径最小;A有两个单电子,E的未成对电子数是前四周期中最多的,且其外围电子数与D相同,F的最外层电子数为2,内层全部排满。请用对应的元素符号回答下面的问题:
(1)写出E的价电子排布式:__________________________________________。
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)_____________________, 键角约为_____________________________________。
(3)下列物质的性质与氢键有关的是__________________________________________
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB-形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB-形成配位键,则E3+的配位数为________,1mol该配离子中含有_____________molσ 键。
(5)在C和D形成的化合物中,中心原子没有孤电子对的分子的空间构型为__________。
(6)根据下列图片说明为什么同周期过渡金属第一电离能变化没有主族元素变化明显__________________________________________。

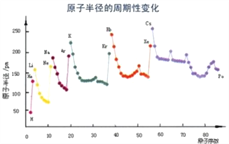
(7)F与D形成的化合物晶胞如图,F的配位数为_____________,晶体密度为a g/cm3,NA为阿伏加德罗常数,则晶胞边长为__________________pm。(1pm=10-10cm)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的变化: 
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式 B;E .
(3)写出②、③两个反应方程式 ②;③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有V L 0.5mol/L的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是( )
A.加热浓缩到原来体积的一半
B.加入0.05mol/L的盐酸0.125V L
C.加入10mol/L的盐酸0.1V L,再稀释至1.5 V L
D.标况下通入11.2L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为A、B、C、D、E之间的相互转换关系A为一种气态单质,D是一种红棕色气体。下列说法正确的是
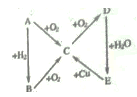
A. C 物质和O2必须在催化剂表面才能反应生成D
B. Cu 和E 溶液反应体现了E 的强氧化性和酸性
C. 可用NaOH 溶液除去混在D物质中的少量B 物质
D. B 生成C 的反应中,氧化剂与还原剂之比为4: 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2—氯丁烷(![]() )与NaOH乙醇溶液共热发生消去HCl分子的反应
)与NaOH乙醇溶液共热发生消去HCl分子的反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 2—丙醇一定条件下发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某种有机物的结构,关于它的性质叙述中正确的是

A. 1mol该有机物在一定条件下,能与7molH2发生加成反应
B. 不能与FeCl3溶液作用发生显色反应
C. 能与NaHCO3反应放出气体
D. 1mol该有机物在一定条件下,能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2 = S4O62- + 2I- 。
(Ⅰ)制备Na2S2O3·5H2O

①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热。圆底烧瓶中发生反应的化学方程式为___________________________________________。
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。C中碳酸钠的作用是_____。“停止C中的反应”的操作是____________________。
③过滤C中的混合液。将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
④装置B中盛放的试剂是(填化学式)_____________溶液,其作用是__________________。
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示:
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
①滴定时,达到滴定终点的现象是______________________________。
②Na2S2O3·5H2O在产品中的质量分数是___________(用百分数表示,且保留1位小数)。
③下列操作中可能使测定结果偏低的是________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入I2的标准液
B.滴定前盛放Na2S2O3溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取I2标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com