
| A. | 68.3% | B. | 74.2% | C. | 92.2% | D. | 78.1% |
分析 根据题意,得到19.2g沉淀碳酸钙的质量求生成二氧化碳的质量,根据反应的化学方程式,由二氧化碳质量计算参加反应四氧化三铁的质量,并完成磁铁矿样品中四氧化三铁的质量分数的计算.
解答 解:设磁铁矿中含Fe3O4的质量为X
4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2
Ca(OH)2+CO2=CaCO3↓+H2O
根据上面的化学方程式得到如下关系式:
Fe3O4~~~~4CO2~~~~4CaCO3
232 400
X 19.2g
$\frac{232}{X}=\frac{400}{19.2g}$
X=11.136g
磁铁矿中Fe3O4的质量分数=$\frac{11.136g}{15.0g}×100%$=74.24%,故选B.
点评 本题是考查根据化学方程式进行计算的题目,学生只要掌握关系式在解题中的巧妙运用就可以迅速解答,比较容易.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
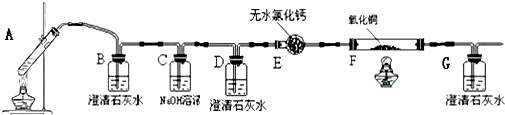
 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 | B. | CH≡CH | C. | CH3C≡CH | D. | CH2═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);
,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);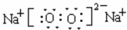 、
、 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 纯碱可用于清洗油污 | |
| C. | 浓氨水可检验氯气管道泄漏 | |
| D. | 水玻璃是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.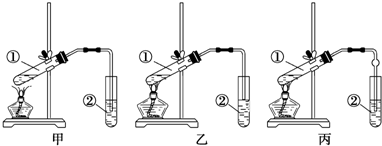
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式-COH | B. | 丙烷分子的比例模型为: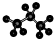 | ||
| C. | 四氯化碳分子的电子式为 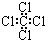 | D. | 2-乙基-1,3-丁二烯的键线式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com