
| A. | 构成有机物的骨干元素是碳 | |
| B. | 构成地壳的骨干元素是Si,在二氧化硅晶体中每个Si原子周围结合4个O原子,每个O原子周围结台2个Si原子,[SiO4]四面体向空间无限伸展,形成立体网状结构 | |
| C. | 单质Si是制作计算机芯片的主要材料,SiO2是制取光导纤维的主要材料 | |
| D. | 空气中含量最大的元素是N.海水中含量最大的元索是C1,太阳系中含量最大的元素是H |
分析 A、生成大分子的基本骨架是碳链;
B、SiO2为原子晶体,在二氧化硅晶体中每个Si原子周围结合4个O原子,每个O原子周围结台2个Si原子,形成立体网状结构;
C、半导体硅晶体制造计算机芯片,光导纤维的主要成分是二氧化硅;
D、海水中含有大量水,水是由氢、氧元素组成,所以含量最大的元素是氧元素.
解答 解:A、生成大分子的基本骨架是碳链,所以构成有机物的骨干元素是碳,故A正确;
B、SiO2为原子晶体,在二氧化硅晶体中每个Si原子周围结合4个O原子,每个O原子周围结台2个Si原子,形成立体网状结构,故B正确;
C、半导体硅晶体制造计算机芯片,光导纤维的主要成分是二氧化硅,故C正确;
D、海水中含有大量水,水是由氢、氧元素组成,所以含量最大的元素是氧元素,而不是氯,故D错误;
故选D.
点评 本题考查了单质硅及其化合物的性质,考查的知识点来源于课本,可以根据所学知识来回答.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
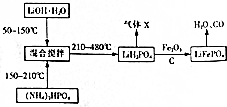
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧产生苍白色的火焰 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 氧化铝熔点高于铝 |
| C | 将SO2通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | SO2具有漂白性 |
| D | 去黄豆粒大小的钠与水反应,钠熔化成闪亮的小球,浮在水面,不断游动,嘶嘶作响,最后消失 | 钠熔点低、密度比水小,放热,具有强还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | FeCl3溶液腐蚀印刷电路:Fe3++Cu=Fe2++Cu2+? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
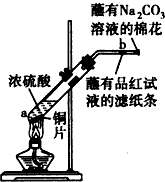 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
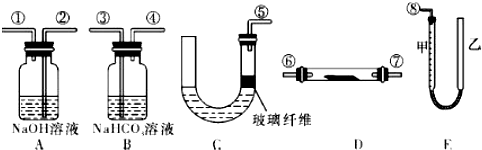
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取一氯乙烷最好采用的方法是乙烷和氯化氢反应 | |
| B. | 化学平衡的标志之一是各物质的浓度相等 | |
| C. | C4H10的同分异构体有3种 | |
| D. | 乙烯能够使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COO Na,水的电离平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com