
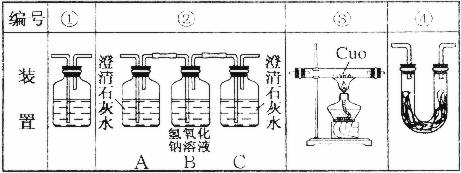
分析 (1)乙醇完全燃烧生成水、二氧化碳;
(2)④是无水硫酸铜,①是澄清石灰水,乙醇燃烧产物中有CO、CO2和H2O,CO可用热的氧化铜,根据固体颜色的变化;检验二氧化碳可以用澄清石灰水,看是否变浑浊;检验水用无水硫酸铜,看是否变蓝色;三者都有时,应先检验水蒸气的存在,因为在验证二氧化碳、一氧化碳的存在时都需通过溶液,可带出水蒸气;再检验二氧化碳,最后除去二氧化碳后,再根据固体颜色变化和产物检验一氧化碳;
(3)根据二氧化碳可以用澄清石灰水变浑浊,氢氧化钠与二氧化碳反应,能吸收二氧化碳,装置②中A瓶的石灰水变浑浊是检验二氧化碳,B中氢氧化钠是吸收二氧化碳,C中瓶的石灰水是检验二氧化碳是否被除尽;
(4)③和①配合来检验一氧化碳,③是反应装置,①用来检验反应产物;
(5)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳的存在时需通过溶液,可带出水蒸气.
解答 解:(1)乙醇完全燃烧的化学方程式为C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O,故答案为:C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O;
(2)检验乙醇燃烧产物中有CO、CO2和H2O,CO可用热的氧化铜,应先用④检验水蒸气的存在,因为在验证二氧化碳、一氧化碳的存在时都需通过溶液,可带出水蒸气;再用②检验二氧化碳,最后除去二氧化碳后,用①干燥CO,再根据固体颜色变化和产物检验一氧化碳,选择③①,所以顺序为④②①③①,
故答案为:④②①③①;
(3)根据二氧化碳可以用澄清石灰水变浑浊,氢氧化钠与二氧化碳反应,能吸收二氧化碳,装置②中A瓶的石灰水变浑浊是检验二氧化碳,B中氢氧化钠是吸收二氧化碳,C中瓶的石灰水是检验二氧化碳是否被除尽,
故答案为:验证CO2存在;除去混合气体中的CO2;证明CO2已被除尽;
(4)③和①配合来检验一氧化碳,③根据颜色变化判断可能含有一氧化碳,并将一氧化碳氧化成二氧化碳,再用①来进一步确认生成的是二氧化碳,所以③的作用是将CO氧化成CO2;通入③之前装置①的作用是除去水蒸汽(或干燥气体),通入③之后装置①的作用是检验由CO与CuO反应所生成的CO2,从而确定有CO气体,
故答案为:CO氧化成CO2;除去水蒸汽(或干燥气体);检验由CO与CuO反应所生成的CO2,从而确定有CO气体;
(5)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳、一氧化碳的存在时都需通过溶液,可带出水蒸气,影响水蒸气的确定,
故答案为:无水硫酸铜; H2O.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、实验装置的作用及实验技能为解答的关键,侧重分析与实验能力的考查,注意燃烧产物的检验顺序,题目难度不大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2、Br2、Cl2、F2 | B. | Li、Na、K、Rb | C. | F2、Cl2、Br2、I2 | D. | F-、Cl-、Br-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA | |
| B. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA | |
| C. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl-离子组能够大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 分析图,按要求写出有关反应方程式:
分析图,按要求写出有关反应方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能含有丙炔 | B. | 一定没有乙烷 | C. | 一定含有甲烷 | D. | 可能有乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com