
ÓŠ¹ŲČČ»Æѧ·½³ĢŹ½ŹéŠ“Óė¶ŌÓ¦±ķŹö¾łÕżČ·µÄŹĒ
A£®Ļ”“×ĖįÓė0.1 mol”¤L£1 NaOHČÜŅŗ·“Ó¦£ŗH£«(aq)£«OH£(aq)===H2O(l) ¦¤H£½£57.3 kJ”¤mol£1
B£®ĆܱÕČŻĘ÷ÖŠ£¬9.6 gĮņ·ŪÓė11.2 gĢś·Ū»ģŗĻ¼ÓČČÉś³ÉĮņ»ÆŃĒĢś17.6 gŹ±£¬·Å³ö19.12 kJČČĮ棬ŌņFe(s)£«S(s)===FeS(s) ¦¤H£½£95.6 kJ”¤mol£1
C£®ĒāĘųµÄČ¼ÉÕČČĪŖ285.5 kJ”¤mol£1£¬ŌņĖ®µē½āµÄČČ»Æѧ·½³ĢŹ½ĪŖ2H2O(l)===2H2(g)£«O2(g) ¦¤H£½£«285.5 kJ”¤mol£1
D£®ŅŃÖŖ2C(s)£«O2(g)===2CO(g) ¦¤H£½£221 kJ”¤mol£1£¬ŌņæÉÖŖCµÄČ¼ÉÕČČĪŖ110.5 kJ”¤mol£1
B
”¾½āĪö”æAĻī“×ĖįŹĒČõµē½āÖŹ£¬²»ÓĆH£«±ķŹ¾£»17.6 gĮņ»ÆŃĒĢśĪŖ0.2 mol£¬·Å³öČČĮæĪŖ19.12 kJ£¬¹ŹÉś³É1 mol FeSŹ±·Å³öµÄČČĮæĪŖ95.6 kJ£¬¹ŹBŃ”ĻīÕżČ·£»Č¼ÉÕČČŹĒÖø1 molæÉČ¼ĪļĶźČ«Č¼ÉÕÉś³ÉĪȶØŃõ»ÆĪļŹ±·Å³öµÄČČĮ棬¼“1 molĒāĘųĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®Ź±·Å³öµÄČČĮæĪŖ285.5 kJ£¬Ōņµē½ā1 mol H2OŹ±ŅŖĪüŹÕ285.5 kJČČĮ棬¹ŹČČ»Æѧ·½³ĢŹ½ĪŖ2H2O(l)===2H2(g)£«O2(g) ¦¤H£½£«285.5”Į2 kJ”¤mol£¬¹ŹCŃ”Ļī“ķĪó£»DĻīĢ¼µÄČ¼ÉÕČČŹĒ1 mol CĶźČ«Č¼ÉÕÉś³ÉCO2Ź±·Å³öµÄČČĮ棬¹ŹDŃ”Ļī“ķĪó”£


 ÓÅŅķŠ”°ļŹÖĶ¬²½æŚĖćĻµĮŠ“š°ø
ÓÅŅķŠ”°ļŹÖĶ¬²½æŚĖćĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»Æѧ»·¾³ĪŪČ¾Óė±£»¤£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
»ÆѧÓėæĘѧ”¢¼¼Źõ”¢Éē»į”¢»·¾³ĆÜĒŠĻą¹Ų”£ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠ“ķĪóµÄŹĒ
A£®ø£µŗŗĖµēÕ¾Š¹Ā©µÄ·ÅÉäŠŌĪļÖŹ131IŗĶ127I»„ĪŖĶ¬Ī»ĖŲ£¬»ÆѧŠŌÖŹ¼øŗõĻąĶ¬
B£®“óĮæČ¼ÉÕ»ÆŹÆČ¼ĮĻÅŷŵķĻĘųÖŠŗ¬ÓŠ“óĮæSO2£¬Ōģ³É“óĘųĪŪČ¾£¬“Ó¶ųŹ¹ÓźĖ®µÄpH£½5.6£¬ŠĪ³ÉĖįÓź
C£®“óĮæÅÅ·ÅNOŗĶNO2µČµŖŃõ»ÆĪļŹĒŠĪ³É¹ā»ÆѧŃĢĪķŗĶĖįÓźµÄŅ»øöÖŲŅŖŌŅņ
D£®øß“æ¶ČµÄ¶žŃõ»Æ¹č¹ć·ŗÓĆÓŚÖĘ×÷¹āµ¼ĻĖĪ¬£¬¹āµ¼ĻĖĪ¬ÓöĒæ¼ī»į”°¶ĻĀ·”±
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»ÆѧĪļÖŹµÄ¼ģŃé£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ijĶ¬Ń§ĪŖ¼ģŃéČÜŅŗÖŠŹĒ·ńŗ¬ÓŠ³£¼ūµÄ¼øÖÖĪŽ»śĄė×Ó£¬½ųŠŠĮĖČēĻĀĶ¼ĖłŹ¾µÄŹµŃé²Ł×÷”£ĘäÖŠ¼ģŃé¹ż³ĢÖŠ²śÉśµÄĘųĢåÄÜŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶”£ÓÉøĆŹµŃéÄܵƵ½µÄÕżČ·½įĀŪŹĒ
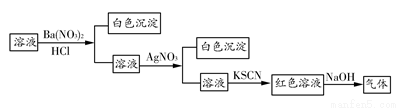
A£®ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠ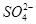
B£®ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠ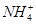
C£®ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠCl£
D£®ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠFe3£«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»ÆŃ§Č¼ÉÕČČÓėøĒĖ¹¶ØĀɣؽāĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖ£ŗHCN(aq)ÓėNaOH(aq)·“Ó¦µÄ”÷H= -12.1kJ /mol£»HCl(aq)ÓėNaOH(aq)·“Ó¦µÄ”÷H = -55.6kJ/ mol”£ŌņHCNŌŚĖ®ČÜŅŗÖŠµēĄėµÄ¦¤HµČÓŚ
A£®-67.7 kJ /mol B£®-43.5kJ /mol
C£®+43.5 kJ/ mol D£®+67.7 kJ/ mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»ÆŃ§Č¼ÉÕČČÓėøĒĖ¹¶ØĀɣؽāĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠŅĄ¾ŻČČ»Æѧ·½³ĢŹ½µĆ³öµÄ½įĀŪÕżČ·µÄŹĒ
A£®ŅŃÖŖ2H2(g)£«O2(g)=2H2O(g) ”÷H=£483.6 kJ”¤mol£1£¬ŌņĒāĘųµÄČ¼ÉÕČČ£Ø”÷H£©ĪŖ-241.8 kJ”¤mol£1
B£®ŅŃÖŖNaOH(aq)£«HCl(aq)=NaCl(aq)£«H2O(l) ”÷H=£57.3 kJ”¤mol£1£¬Ōņŗ¬40.0g NaOHµÄĻ”ČÜŅŗÓėĻ”“×ĖįĶźČ«ÖŠŗĶ£¬·Å³öŠ”ÓŚ57.3kJµÄČČĮæ
C£®¼ŗÖŖ2C(s)£«2O2(g)=2CO2(g) ”÷H = a£»2C(s)£«O2(g)=2CO(g)£»”÷H= b£¬Ōņa£¾b
D£®ŅŃÖŖC (ŹÆÄ«£¬s)=C (½šøÕŹÆ£¬s) ”÷H£¾0£¬Ōņ½šøÕŹÆ±ČŹÆÄ«ĪȶØ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»ÆѧČܶȻż”¢³ĮµķµÄÉś³É”¢Čܽā”¢×Ŗ»Æ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚt ”ꏱ£¬AgBrŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾”£ÓÖÖŖt ”ꏱAgClµÄKsp£½4”Į10£10£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
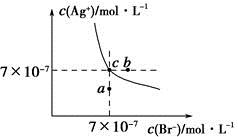
A£®ŌŚt ”ꏱ£¬AgBrµÄKspĪŖ4.9”Į10£13
B£®ŌŚAgBr±„ŗĶČÜŅŗÖŠ¼ÓČėNaBr¹ĢĢ壬æÉŹ¹ČÜŅŗÓÉcµć±äµ½bµć
C£®Ķ¼ÖŠaµć¶ŌÓ¦µÄŹĒAgBrµÄ²»±„ŗĶČÜŅŗ
D£®ŌŚt ”ꏱ£¬AgCl(s)£«Br£(aq)  AgBr(s)£«Cl£(aq)Ę½ŗā³£ŹżK”Ö816
AgBr(s)£«Cl£(aq)Ę½ŗā³£ŹżK”Ö816
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»ÆѧĖ®µÄµēĄėÓėČÜŅŗĖį¼īŠŌ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻąĶ¬ĪĀ¶ČĻĀ£¬ŌŚĖ®ÖŠ·Ö±š¼ÓČėĻĀĮŠĪļÖŹ£¬ČōÓĆKw±ķŹ¾Ė®µÄĄė×Ó»ż£¬a±ķŹ¾Ė®µÄµēĄė³Ģ¶Č£¬ÄÜŹ¹a/KwµÄÖµŌö“óµÄŹĒ
A£®NaOH B£®NaHSO4 C£®HC1 D£®NH4NO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»ÆѧĀČ”¢ä唢µā¼°Ęä»ÆŗĻĪļÖ÷ŅŖŠŌÖŹ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
“Óµ»Æŗ£Ė®ÖŠĢįČ”äåµÄĮ÷³ĢČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ
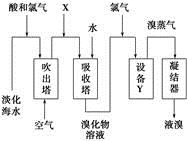
A£®XĪŖSO2ĘųĢ壬Ņ²æɽ«SO2»»³ÉNa2SO3
B£®Éč±øYĪŖÕōĮóĖž
C£®ŌŚĢįČ”äåµÄ¹ż³ĢÖŠŅ»¶ØÓŠBr£±»Ńõ»Æ
D£®¹¤ŅµÉĻĆæ»ńµĆ1 mol Br2£¬ŠčŅŖĻūŗÄCl2µÄĢå»ż×ī¶ąĪŖ44.8 L(±ź×¼×“æöĻĀ)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼ĆūŹ¦ĶĘ¼ö»ÆѧŃõ»Æ»¹Ō·“Ó¦µÄøÅÄī£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
»š·ØĮ¶ĶŹ×ĻČŅŖ±ŗÉÕ»ĘĶæó£¬Ęä·“Ó¦ĪŖ2CuFeS2£«O2”Ŗ”śCu2S£«2FeS£«SO2ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ A£®SO2¼ČŹĒŃõ»Æ²śĪļÓÖŹĒ»¹Ō²śĪļ
B£®CuFeS2½ö×÷»¹Ō¼Į£¬ĮņŌŖĖŲ±»Ńõ»Æ
C£®ĆæÉś³É1 mol Cu2S£¬ÓŠ4 molĮņ±»Ńõ»Æ
D£®Ćæ×ŖŅĘ1.2 molµē×Ó£¬ÓŠ0.2 molĮņ±»»¹Ō
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com