
 ,故答案为:
,故答案为: ;
; ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
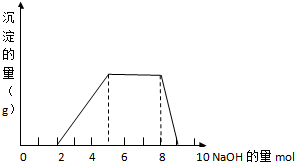 某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)
某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)查看答案和解析>>
科目:高中化学 来源: 题型:
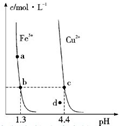 某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )
某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )| A、Ksp〔Fe (OH)3〕<Ksp〔Cu (OH)2〕 |
| B、加适量NH4Cl固体可使溶液由a 点变到b点 |
| C、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| D、Fe (OH)3、Cu (OH)2分别在b、c两点代表的溶液中达到饱和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
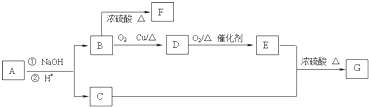
查看答案和解析>>
科目:高中化学 来源: 题型:
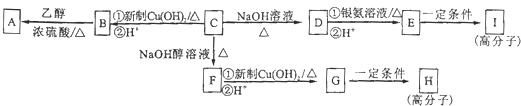
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
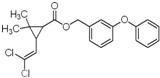
| A、分子式为C21H20Cl2O3 |
| B、不能使溴水褪色 |
| C、1mol氯菊酯与氢气加成最多消耗8 mol H2 |
| D、与NaOH溶液反应最多消耗4mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com