
| A. | 工业冶炼铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 火法炼铜Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 工业冶炼镁MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2 | |
| D. | 工业冶炼铝Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al |
分析 金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,例如:2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑,
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,例如:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO2↑,
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,例如:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
根据金属的活泼性确定金属的冶炼方法.
解答 解:A.Fe是金属活动性顺序表中处于中间位置的金属,工业上采用热氧化还原法冶炼,故A正确;
B.Cu是金属活动性顺序表中处于中间位置的金属,所以可以采用热氧化还原法冶炼Cu,故B正确;
C.Mg是活泼金属,工业上采用电解熔融氯化镁的方法冶炼,故C正确;
D.Al是较活泼金属,工业上采用电解熔融氧化铝的方法冶炼,故D错误;
故选D.
点评 本题考查金属的冶炼,明确金属活泼性强弱与冶炼方法的关系是解本题关键,会根据金属的活泼性强弱选取合适的冶炼方法,易错选项是D,注意工业上不能采用电解熔融氯化铝的方法冶炼铝,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
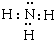 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
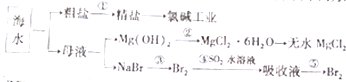 海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )| A. | 大量的氮、磷废水排入海洋,易引起赤潮 | |
| B. | 空气吹出法是用于工业规模海水提溴的常用方法 | |
| C. | 在过程③中溴元素被氧化,而在过程④中溴元素被还原 | |
| D. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+、等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化学实验中需要用温度计的有石油分馏、硝基苯的制备和乙烯的制取 | |
| B. | 用溴水可以鉴别苯酚溶液、甲苯、乙醇和苯乙烯 | |
| C. | 用酒精可以处理粘在皮肤上的苯酚或苯酚醛树脂制备实验后的试管 | |
| D. | 取适量卤代烃水解后产物,直接滴加AgNO3溶液以确定卤原子种类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g | |
| C. | 铝跟氢氧化钠溶液反应,生成3.36 L H2,转移的电子数为0.3 NA | |
| D. | 50 mL 8 mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com