
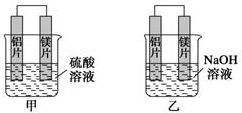
分析 甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O═2NaAlO2+3H2↑.由于Al显两性,与酸碱都能发生反应,(1)甲中镁易失电子作负极,Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)乙池中铝易失电子作负极,铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验证明说明电解质溶液性质选用选择合适的介质,不能说明金属活动性顺序过时;
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
解答 解:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,在原电池中,阴离子移向负极,即硫酸根离子移向负极.
故答案为:氧化;负极;2H++2e-=H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,
故答案为:Mg;Al;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故A正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故B错误;
C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,故C错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故D正确;
故答案为:AD.
点评 本题考查了探究原电池原理,题目难度中等,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 3:2:1 | C. | 3:1:2 | D. | 4:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | KNO3 | C. | HCl | D. | CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池属于二次电池 | |
| B. | 锂离子电池是一种一次性电池 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 镍镉电池中,Cd为负极,NiO(OH)为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的分子式 | B的分子式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应,一定是吸收能量的反应 | |
| B. | 在化学反应过程中总是伴随着能量的变化 | |
| C. | 释放能量的反应在常温下一定很容易发生 | |
| D. | 在确定的化学反应中反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙的阳离子可能不是主族元素 | B. | 乙可能是硝酸铝 | ||
| C. | 甲可能是硫酸钠 | D. | 所得溶液呈弱酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com