
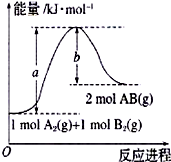
 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.分析 (1)反应热等于反应产物具有的能量和反应物具有的能量之差;
(2)常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
(3)向一固定容积的密闭容器中通入2molSO2和1molO2,和向该容器中通入2molSO3,建立的平衡是等效的.
解答 解:(1)该反应的反应热焓变等于反应产物具有的能量和反应物具有的能量之差,即△H=(a-b)kJ/mol,热化学方程式为:A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol,故答案为:A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol;
(2)①氢气的燃烧属于放热反应,故错误;
②碳酸钙分解的反应属于吸热反应,故正确;
③锌和硫酸生成氢气的反应是放热反应,故错误;
④Ba(OH)2•8H2O与NH4Cl反应是吸热反应,故正确;
⑤碳和水蒸气生成氢气和一氧化碳的反应是吸热反应,故正确;
⑥酸碱中和反应是放热反应,故错误;
⑦需要加热的反应.有的属于放热反应,有的属于吸热反应,故错误.
故选②④⑤;
(3)向一固定容积的密闭容器中通入2molSO2和1molO2和向该容器中通入2molSO3,建立的平衡是等效的,Q1+Q2=196.64,
故答案为:Q1+Q2=196.64.
点评 本题考查反应热的计算的热化学方程式的书写知识,题目难度中等.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L 1 mol•L-1的Na2CO3 溶液中含有的阴离子数目大于NA | |
| B. | 标准状况下,2.24LCCl4中含有共价键总数为0.4NA | |
| C. | 常温常压下,18g D2O的原子总数为3NA | |
| D. | 7.1g Cl2与足量的Fe反应,转移电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| B. | 向海水中加净水剂明矾可使海水淡化 | |
| C. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| D. | 服用抗氧剂维生素C有利于人体对铁元素的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数与中子数均为20的钙原子:2040Ca | |
| B. | 氮分子的电子式::N:::N: | |
| C. | 氯离子(Cl-)的结构示意图: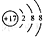 | |
| D. | 聚乙炔的结构简式: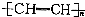 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
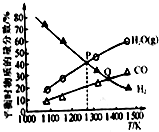 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )| A. | 容器内的总压:P点<Q点 | |
| B. | 正反应速率:v(Q)<v(P) | |
| C. | P点对应温度时,H2的平衡转化率为40% | |
| D. | P点对应温度的平衡常数的值为2.5×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2S晶体中含有的S2-数目小于0.1NA | |
| B. | 1.68g铁与足量水蒸气反应,转移的电子数目为0.09NA | |
| C. | 11g由31H和168O组成的超重水中,含有的中子数目为5NA | |
| D. | 与17gH2O2所含非极性键数目相同的N2H4的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
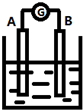 如图为原电池装置示意图:
如图为原电池装置示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器内压强不随时间变化 | |
| B. | P和S的生成速率相等 | |
| C. | 反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1 | |
| D. | 反应容器内总物质的量不随时间而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com