
| A. | 铝热反应 | B. | 燃料燃烧 | ||
| C. | 酸碱中和反应 | D. | Ba(OH)2•8H2O与NH4Cl固体混合 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 明矾水解形成氢氧化铝胶体能杀菌消毒,可用水的净化 | |
| D. | 硫酸亚铁补铁剂应与维生素C同服,是因为维生素C可以防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
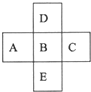
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后,形成的N-H键数目为0.6NA | |
| B. | 若由CO2和O2组成的混合物共有NA个分子,则其中所含的氧原子数为2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中的氢原子数为0.4NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体(标况下)时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸可以用于除去锅炉或水壶中的水垢 | |
| B. | 切开的苹果放置后变色和纸张久置后变黄的原理相同 | |
| C. | 蜂蚁蛰咬人时会向人体注入酸性物质,可涂抹小苏打溶液缓解疼痛 | |
| D. | 工业含酸废水可用氢氧化钡溶液处理后再排放,有利于减少水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可做消毒剂 | |
| B. | 铝制品抛光车间须严格控制粉尘浓度以防爆炸 | |
| C. | 氧化铝可作耐火材料 | |
| D. | 金属铝无需经过特别处理就具有抗腐蚀能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
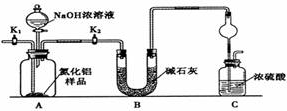
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
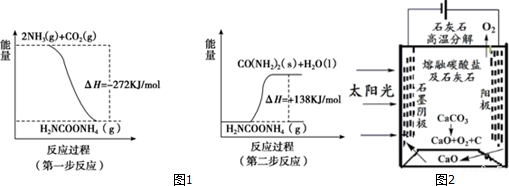
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
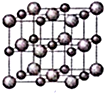 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
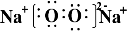 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、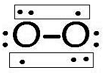 ,其分子空间构型为直线型.
,其分子空间构型为直线型.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com