
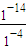 mol?L-1=1.0×10-10mol?L-1,故A错误;
mol?L-1=1.0×10-10mol?L-1,故A错误;

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2011届上海市松江区高三5月模拟测试化学试卷 题型:单选题
向蒸馏水中加入一定量的NaHSO3晶体,保持常温,测得溶液的pH=4,下列说法正确的是
| A.水电离出的H+的浓度是1.0×10-4 mol·L-1 |
| B.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源:松江区模拟 题型:单选题
| A.水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D.溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com