
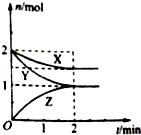
 在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:分析 (1)由图可知,平衡时△n(Y)=2mol-1mol=1mol,△n(Z)=1mol,物质的量之比等于化学计量数之比;
(2)根据c=$\frac{n}{V}$计算Y的平衡浓度;
(3)△n(X)=$\frac{1}{2}$△n(Y)=0.5mol,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(X).
解答 解:(1)由图可知,平衡时△n(Y)=2mol-1mol=1mol,△n(Z)=1mol,则1:1=2:n,故n=2,
故答案为:2;
(2)平衡时Y为1mol,Y的平衡浓度为$\frac{1mol}{2L}$=0.5mol/L,
故答案为:0.5mol/L;
(3)由方程式可知△n(X)=$\frac{1}{2}$△n(Y)=0.5mol,则v(X)=$\frac{\frac{0.5mol}{2L}}{2min}$=0.125mol/(L.min),
故答案为:0.125mol/(L.min).
点评 本题考查化学平衡计算、反应速率计算,比较基础,有利于基础知识的巩固.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++HSO4- | B. | Al2(SO4)3═2Al3++3SO42- | ||
| C. | NH4Cl═NH3+H++Cl- | D. | H2CO3═2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 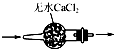 干燥SO2气体 | |
| B. | 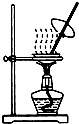 蒸发CH3COONa溶液得醋酸钠晶体 | |
| C. | 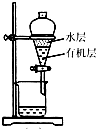 分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 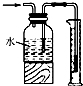 测量氯气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2NH3→2NaNH2+H2↑ | B. | NH3+HNO3→NH4NO3 | ||
| C. | 4NH3+6NO→5N2+6H2O | D. | 3SiH4+4NH3→Si3N4+12H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com