
【题目】关于SO2气体的叙述中,正确的是( )
A.SO2的摩尔质量是64 g
B.1mol SO2中所含分子数约为6.02×1023
C.1 mol SO2的质量是64 g·mol-1
D.25℃,1.01×105Pa下,1 mol SO2的体积为22.4 L
科目:高中化学 来源: 题型:
【题目】下列物质的沸点由高到低排列的顺序是
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3⑤(CH3CH2)2CHCl
A.⑤②④①③ B.④②⑤①③ C.⑤④②①③ D.②④⑤③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是____________(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的电子式为____________;
(4)E的最高价氧化物的水化物的化学式为____________;
(5)单质C在空气中燃烧的产物存在的化学键类型为 ;其反应化学方程式为 ;
(6)单质E与水反应的离子方程式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化亚铁和氯化铁的混合物.现要测定其中铁元素的质量分数,按如图步骤进行实验: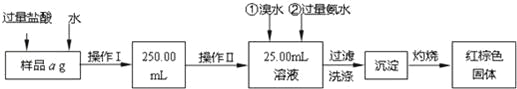
请根据以上流程,回答下列问题:
(1)样品溶解过程中加入少量浓盐酸的目的是什么?
操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有哪些仪器?
操作Ⅱ中可用的玻璃仪器是什么仪器?
(2)请写出加入氨水发生的离子反应方程式。
(3)沉淀洗涤的方法是什么?
(4)将沉淀物灼烧,冷却到室温,用天平称量其质量为b1g,再次灼烧并冷却至室温称量其质量为b2g,若b1﹣b2=0.3g,则接下来还应进行的操作是 .若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的密闭容器中通入a mol CO和b mol O2,点燃充分反应后容器内碳原子数和氧原子数之比为( )
A.a:2b
B.a:(a+2b)
C.a:2(a+b)
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( )
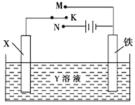
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O
C.放电时正极附近溶液的碱性增强
D.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式_________________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如右图所示。


①T℃时该化学反应的平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_______移动。(填“向左”、“向右”或“不)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_______。
Ⅱ.SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是___________________。
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____________,阴极的电极反应式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com