
【题目】把4.6 g钠放入200 mL 0.1 mol·L-1 AlCl3溶液中,待其充分反应后,下列叙述中正确的是 ( )
A. Cl-的浓度几乎不变
B. 溶液变浑浊
C. 溶液中Al3+全部转化为AlO![]()
D. 溶液中存在最多的离子是Na+
【答案】A
【解析】
4.6g钠的物质的量为4.6 g÷23 g/mol=0.2 mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.2 mol,AlCl3的物质的量为0.2L×0.1molL-1=0.02 mol,n(Al3+):n(OH-)=0.02 mol∶0.2 mol=1∶10,Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余;A.参加反应的水很少,溶液的体积基本不变,氯离子不反应,Cl-的浓度几乎不变,故A正确;B.Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,溶液不变浑浊,故B错误;C.Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,但AlO![]() 在溶液中会部分水解,故C错误;D.溶液中Na+为0.2 mol,氯离子为0.6 mol,Al3+为0.2 mol-0.2 mol/3=2/15 mol,溶液中存在最多的离子是氯离子,故D错误;故选A。
在溶液中会部分水解,故C错误;D.溶液中Na+为0.2 mol,氯离子为0.6 mol,Al3+为0.2 mol-0.2 mol/3=2/15 mol,溶液中存在最多的离子是氯离子,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】某同学在实验室研究Fe与H2SO4的反应
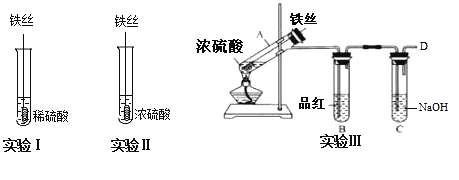
【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__.
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为__.
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是__,装置C的作用是__.
(4)实验Ⅲ结束后,
甲同学认为装置C中产生Na2SO3,
乙同学认为SO2过量,产物中还可能含有_________,
丙同学认为可能还含有Na2SO4,设计简单实验验证是否含有SO42-,正确的是(____)
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的S元素,稀硫酸的氧化性源于________.
②影响反应产物多样性的因素有_____________________(至少填两个).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 蒸发结晶时应将溶液蒸干
D. 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
P(s)+5/4O2(g)=1/4P4O10(s) △H=-738.5kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一透明溶液,可能含有大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO![]() 、CO
、CO![]() 中的一种或几种,取此溶液做下列实验:
中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断:

(1)溶液中一定含有的离子是______________。
(2)溶液中肯定不含有的离子是________________。
(3)可能含有的离子是____________,若要确定该离子的存在需要用到的实验方法是____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com