
| 2.4mol |
| 2.4mol/L |


科目:高中化学 来源:不详 题型:单选题
| A.收集氨气的原理是向下排空气法 |
| B.干燥管的作用是防止倒吸 |
| C.当烧杯中的水变红时证明氨气已收集满 |
| D.该装置会形成红色喷泉 |
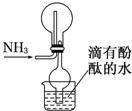
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
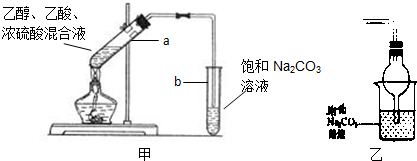
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①⑤④②③ | B.④①②⑤③ | C.④⑤②①③ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
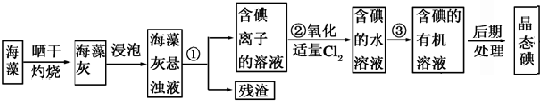
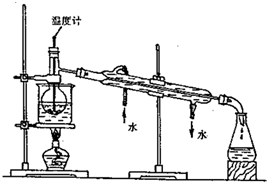
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.主要玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 |
| B.定容时俯视容量瓶的刻度线会导致所配制的溶液浓度偏低 |
| C.量取浓硫酸后用蒸馏水把量筒洗涤2至3次,然后把洗涤液倒入容量瓶导致所配制的溶液浓度偏高 |
| D.摇匀后,发现液面低于容量瓶刻度线后继续加水至凹液面与刻度线相切导致所配制的溶液浓度偏高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶使用前经蒸馏水清洗后没有干燥 |
| B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C.俯视确定凹液面与刻度线相切 |
| D.用敞口容器称量NaOH且时间过长 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com