

分析 (1)根据水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度;根据除杂时不能引入新的杂质;
(2)①根据Ca(HCO3)2和Mg(HCO3)2的性质分析水垢形成的过程、写出水垢形成的过程的化学方程式;
②反应生成的二氧化碳能溶于水,要加热除去;
③EDTA标准溶液的浓度和消耗的体积,求出金属离子的物质的量,再求出氧化钙的质量和水的硬度;
(3)①碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
②Cr3+废水有毒,可使Cr3+生成沉淀过滤除去.
解答 解:(1)因水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度;已知水中主要含Ca2+、Mg2+、Cl-和SO42-,则该硬水的硬度属于永久硬度;因除杂时不能引入新的杂质,过量的钙离子通过纯碱来除去,故先加石灰,后加纯碱,
故答案为:永久; 石灰;纯碱;
(2)①由于自然界的水中大都溶有一定量的Mg(HCO3)2,在受热时生成Mg(OH)2,这种白色固体在容器内壁上积淀,即形成水垢,所以水垢形成的过程的方程式为Mg(HCO3)2=Mg(OH)2↓+2CO2↑,故答案为:Mg(HCO3)2=Mg(OH)2↓+2CO2↑;
②预处理的方法是向水样中加入浓盐酸,盐酸与Mg(HCO3)2反应生成二氧化碳,CO2能溶于水,所以要加热煮沸除去,故答案为:除去溶解的CO2;
③根据已知反应可知滴定前溶液为酒红色,滴定结束后为蓝色,所以溶液颜色变化为酒红色变为蓝色;
用0.01000mol•L-1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则n(M2+)=n(EDTA)=0.01000mol•L-1×15.00×10-3=1.5×10-4mol,
则25ml水中m(CaO)=nM=56g/mol×1.5×10-4mol=8.2mg,所以1L水中m(CaO)=8.2mg×1000÷25=336mg,通常把1L水中含有10mg CaO称为1度,所以该地下水的硬度为336mL÷10mL=33.6度,
故答案为:33.6度;
(3)①步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
②Cr3+废水有毒,可使Cr3+生成沉淀过滤除去,故调节废水pH,使其转化成Cr(OH)3沉淀除去,故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去.
点评 本题综合考查物质的分离提纯以及硬水的处理,为高频考点,侧重于学生的分析能力和实验能力的考查,有利于培养学生良好的科学素养,注意把握制备流程中的反应、混合物分离方法为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 都是共价化合物 | |
| B. | SiO2可用于制光导纤维,干冰可用于人工降雨 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | 都是酸性氧化物,都能与强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
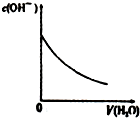 | 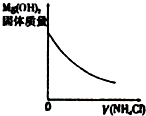 | 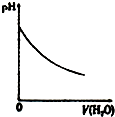 | 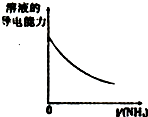 |
| A、盐酸加水稀释 | B、Mg(OH)2悬浊液中滴加NH4Cl溶液 | C、NH4Cl稀溶液加水稀释 | D、NH3通入醋酸溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸混合:2H++CO32-═CO2↑+H2O | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| C. | 亚硫酸钠溶液与稀硫酸混合:2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热:MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸、氢氧化钠溶液能导电,所以它们都是电解质 | |
| B. | 电解质溶液通电时,电解质才能发生电离 | |
| C. | 水溶液能导电的化合物不一定是电解质 | |
| D. | 难溶物质肯定不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:5 | C. | 1:10 | D. | 1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| F | x+3 | x+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液中:Cu2+、Mg2+、SO42-、NO${\;}_{3}^{-}$ | |
| C. | 0.1mol•L-1FeCl2溶液中:Al+、Ca2+、SCN-、ClO- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com