
【题目】下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对于反应:2HI(g)![]() H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.棕红色气体NO2(2NO2![]() N2O4)缩小体积加压后,颜色先变深后变浅
N2O4)缩小体积加压后,颜色先变深后变浅
科目:高中化学 来源: 题型:
【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售盐酸的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测盐酸溶液20.00mL于锥形瓶中,向其中滴加2滴___作指示剂。
(2)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为____mL。
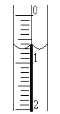
(3)滴定。当___时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(4)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL = 15.24mL。
指出他的计算的不合理之处:___。按正确数据处理,可得c(待测盐酸)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )
A. 2:1:2 B. 1:1:2 C. 2:2:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由质子数小于18的元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
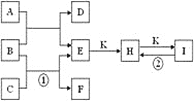
请回答下列问题:
(1)物质A的化学式为________;
(2)化合物I的化学式为________;
(3)反应①的离子方程式为_____________;
(4)反应②的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3的分解有催化作用:
O3+Cl === ClO+O2 ΔH1
ClO+O === Cl+O2 ΔH2
大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化如图:
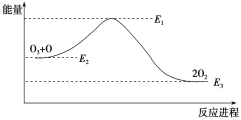
下列叙述中,正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. 2O2===O3+O 是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:![]()
![]() ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min | 0 | 10 | 20 | 30 | 40 |
| 0.80 | 0.60 | 0.48 |
|
|
| 0.00 | 0.20 |
| 0.40 | 0.40 |
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为![]()
C.保持其他条件不变,升高温度,平衡时,![]() ,则
,则![]()
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.固体A由四种元素组成的化合物,为探究固体A的组成,设计并完成如实验:
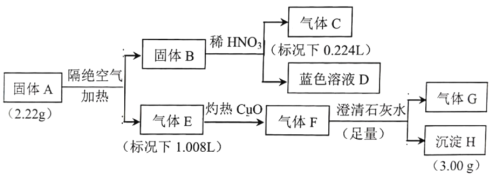
已知:固体B是一种单质,气体E、F都是G和另外一种气体组成。
请回答:
(1)组成A的四种元素是__________,气体E是__________。
(2)固体A隔绝空气加热分解的化学方程式是__________。
(3)蓝色溶液D和乙醇反应可获得固体A,同时还生成一种常见的温室气体,该反应的化学方程式为__________。
Ⅱ.某化学兴趣小组为探究SO2与![]() 溶液的反应,用如下装置(夹持、加热仪器略)进行实验:制备SO2,将SO2通入
溶液的反应,用如下装置(夹持、加热仪器略)进行实验:制备SO2,将SO2通入![]() 溶液中,迅速反应,得到无色酸性溶液和白色沉淀。
溶液中,迅速反应,得到无色酸性溶液和白色沉淀。
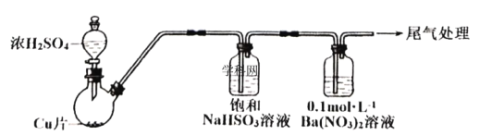
(1)SO2通入![]() 溶液中,得到无色酸性溶液和白色沉淀的离子方程式是__________。
溶液中,得到无色酸性溶液和白色沉淀的离子方程式是__________。
(2)若通入![]() 溶液中的SO2已过量,请设计实验方案检验__________。
溶液中的SO2已过量,请设计实验方案检验__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。
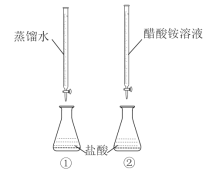
下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com