
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 对于吸热反应、放热反应,反应速率同等程度加大
C. 体系中活化分子总数不变
D. 使反应体系的活化分子百分数增大
科目:高中化学 来源: 题型:
【题目】对处于元素周期表中下列位置的①~⑩十种元素,根据有关要求回答:
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)能形成共价键的元素共有____种。
(2)只需形成一个共价单键就能达到稳定结构的元素有_______ (填元素符号)。
(3) 彼此间形成共价化合物数量最多的两种元素分别是____(填元素符号)。
(4)写出⑩的最低正价含氧酸电子式________;
写出含氧量最高的离子化合物与共价化合物的电子式__________、___________
(5)写出 ①⑤⑦⑨形成的化合物熔融状态下的电离方程式:_____________________
写出该化合物与⑧的最高价氧化物反应的离子方程式______________________
(6)气态氢化物溶于水呈碱性的元素是____(填元素名称),写出其气态氢化物与其最高价氧化物对应的水化物反应的离子方程式:_____________________________
(7)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为__,它与③形成的化合物的化学式为___,含有的化学键类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO![]() 、SO
、SO![]() 、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO
、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO![]() 不共存)
不共存)

(1)水样中一定含有的阴离子是_____,其物质的量浓度之比为_____.
(2)写出BC段所表示反应的离子方程式:_____.
(3)由B到C点变化过程中消耗硝酸的体积为_____.
(4)试根据实验结果推测K+是否存在?_____(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是_____.(若K+不存在,则不必回答该问).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A.硅是非金属元素,它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质发生反应
D.加热到一定温度时,硅能与氯气、氧气等非金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐(NaCl)是生活中常用的调味品,胃酸的主要成分是盐酸。下列关于两种物质的说法正确的是( )
A. 炒菜时放入食盐并不破坏NaCl中的化学键
B. 胃舒平(主要成分氢氧化铝)与胃酸反应生成的AlCl3属于离子化合物
C. NaCl熔化时破坏共价键
D. 盐酸中的溶质HCl属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。

(1)当有1molNa+通过阳离子交换膜时,a极生成气体__________L(标准状况),阳极的电极反应式是______________________________。
(2)稀NaOH溶液的作用是____________,B处流出较浓的NaOH溶液,C处流出的是________________。
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40m3,理论上需要消耗甲烷___________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一个容积为3L的真空密闭容器中通入1molN2和3molH2,2min后,测得容器内的压强是开始时的0.8倍,则这段时间内V(H2)为( )
A.0.2mol/(L·min)B.0.6mol/(L·min)
C.0.1mol/(L·min)D.0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示。
![]()
![]()
![]() +H2O
+H2O
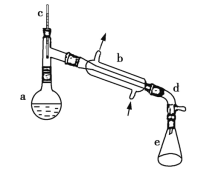
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL 浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是___________________。
(2)加入碎瓷片的作用是___________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___________________ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并___________________;在本实验分离过程中,产物应该从分液漏斗的___________________ (填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是___________________。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____________ (填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com