
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其它物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | / |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
分析 (1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高;
(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,少量蒸馏水,溶液的体积相同.
解答 解:(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4-为氧化剂,H2C2O4为还原剂,
故答案为:MnO4-;
(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ、Ⅱ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ,
故答案为:Ⅰ;Ⅱ;Ⅰ;Ⅲ;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加少量蒸馏水确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同,
故答案为:浓度;确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同.
点评 本题考查氧化还原反应及影响反应速率的因素,注意控制变量法研究影响因素,把握表格中的数据分析及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4褪色 | B. | 溴乙烷在NaOH乙醇溶液中加热 | ||
| C. | 乙醛的银镜反应 | D. | 溴乙烷在NaOH水溶液中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
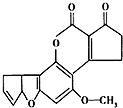 黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )
黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )| A. | 6mol,2mol | B. | 7mol,2mol | C. | 6mol,1mol | D. | 7mol,1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和体积一定时,容器内压强不再变化 | |
| B. | 生成H2和生成HI的速率相等 | |
| C. | 混合气体的颜色不再变化 | |
| D. | 各物质的物质的量浓度之比为2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾可以检验CH2=CH-CHO中碳碳双键 | |
| C. | 将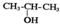 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| D. | 向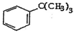 中通入足量的酸性高锰酸钾溶液可以得到 中通入足量的酸性高锰酸钾溶液可以得到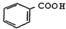 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
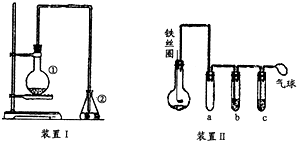 为探究苯与溴的取代反应,甲同学用如图所示的装置Ⅰ进行实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
为探究苯与溴的取代反应,甲同学用如图所示的装置Ⅰ进行实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应. .
. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂.洗涤后分离粗产吕应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂.洗涤后分离粗产吕应使用的仪器是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g)放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g)的△H<0 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com