
| A. | 在中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 用碱式滴定管量取25.00mL高锰酸钾溶液 | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
分析 A.容量瓶和锥形瓶不需要润洗,滴定管需要润洗;
B.高锰酸钾溶液具有强氧化性,能氧化碱式滴定管中的橡胶管;
C.冰醋酸加水过程中,促进冰醋酸电离,氢离子浓度先增大后减小;
D.水的离子积常数随温度的升高而增大.
解答 解:A.容量瓶和锥形瓶不需要润洗,若润洗一定有误差,而滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用,不润洗相当于稀释,也存在误差,故A正确;
B.高锰酸钾溶液具有强氧化性,能氧化碱式滴定管中的橡胶管,所以用酸式滴定管量取25.00mL高锰酸钾溶液,故B错误;
C.冰醋酸是分子晶体,向冰醋酸中加水,促进冰醋酸电离,氢离子浓度逐渐增大,增大到一定程度时,再向溶液中加水稀释,溶液中离子浓度反而减小,故C错误;D.温度越高水的离子积常数越大,所以25℃时NH4Cl溶液的KW小于100℃时NaCl溶液的KW,故D错误;
故选A.
点评 本题考查了弱电解质的电离以及电离平衡的移动、化学仪器的使用,水的离子积常数等等,题目难度不大,注意把握影响水的离子积的因素,侧重于考查学生的分析能力和对基础知识的应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、丙三醇都是无色溶于水的有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 是原子半径最小的元素 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 是短周期元素中原子半径最大的主族元素. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
| F | 原子有三个电子层,且最外层电子数是最内层电子数的3倍, |
 ;
;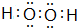 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体KHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量NH4Cl固体,平衡正向移动,c(H+)降低 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管读数时,滴定前正确读数,滴定后俯视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未干燥,带有水珠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
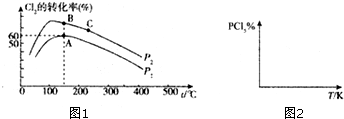
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com