
下列离子方程式正确的是( )
|
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH一═H2O |
|
| B. | 铝与稀盐酸反应:Al+2H+═Al3++H2↑ |
|
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH一═Fe(OH)3↓+3Cl﹣ |
|
| D. | 二氧化碳与石灰水反应:CO2+2OH一═CO32一+H2O |
| 离子方程式的书写. | |
| 专题: | 离子反应专题. |
| 分析: | A、强酸强碱中和反应生成盐和水; B、选项中 离子方程式电荷不守恒; C、氯化铁是强电解质水溶液中完全电离; D、二氧化碳与石灰水反应生成碳酸钙沉淀或碳酸氢钙; |
| 解答: | 解:A、稀硝酸与氢氧化钾溶液反应生成硝酸钾和水,反应的离子方程式为:H++OH﹣=H2O,故A正确; B、铝与稀盐酸反应2Al+6H+=2Al3++3H2↑,故B错误; C、氯化铁溶液与氢氧化钠溶液反应,实质是铁离子和氢氧根离子反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3OH﹣=Fe(OH)3↓+3C1﹣;故C错误; D、少量二氧化碳与石灰水反应生成碳酸钙沉淀,反应的离子方程式为:CO2+2OH﹣=CaCO3↓+H2O,故D错误; 故选A. |
| 点评: | 本题考查了离子方程式的书写方法和注意问题,主要考查离子方程式的电荷守恒,强电解质的判断,量不同产物不同,题目难度中等. |


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
绿色化学的核心是反应过程的绿色化,要求原料物质中的所有原子完全被利用且全部转入期望的产品中.下列过程不符合这一思想的是( )
|
| A. | 甲烷、CO合成乙酸乙酯:2CH4+2CO |
|
| B. | 烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2 |
|
| C. | 乙醇被氧气催化氧化成乙醛 |
|
| D. | 氯乙烯合成聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于加成反应的是( )
|
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
|
| B. |
|
|
| C. |
|
|
| D. | CH3COOH+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
材料的不断发展可以促进社会进步.
①“玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是 、、 (任答一点).
②碳化硅硬度很大,它属于 (填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 .

查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
|
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO﹣)>c(OH﹣)>c(H﹣) |
|
| B. | 等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3) |
|
| C. | 将0.2mol.L﹣1的某一元酸HA溶液和0.1mol.L﹣1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH﹣)+c(A﹣)=2c(H+)+c(HA) |
|
| D. | 某溶液中水电离出的c(OH﹣)=1×10﹣amol.L﹣1若a>7时,则pH该溶液的一定为14﹣a |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
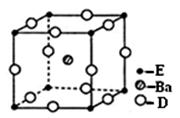 (4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①H2O(g)====H2O(l) ΔH=- Q 1 kJ·mol-1
②C2H5OH(g)====C2H5OH(l) ΔH=- Q 2 kJ·mol-1
③C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1
下列判断正确的是( )
A.酒精的燃烧热为Q3 kJ
B.若使23 g液态酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3) kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.由反应③可知1 mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com