
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点下降 | |
| C. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| D. | 同主族元素随原子核电荷数的递增,原子半径依次增大 |
分析 A.主族元素的族序数等于最外层电子数;
B.ⅦA族元素的单质,为分子晶体,相对分子质量大的熔沸点大;而ⅠA族单质为金属晶体,半径大的熔沸点低;
C.非金属性最强的元素为F,没有正价;
D.同主族元素从上到下原子半径增大.
解答 解:A.主族元素的族序数等于最外层电子数,副族元素等不存在此规律,故A错误;
B.ⅦA族元素的单质,为分子晶体,相对分子质量大的熔沸点大,则随分子量的增大,熔、沸点升高;而ⅠA族单质为金属晶体,半径大的熔沸点低,则随原子序数增大,熔沸点减小,金属不存在分子量,故B错误;
C.非金属性最强的元素为F,没有正价,则不存在最高价氧化物的水化物,故C错误;
D.同主族元素从上到下原子半径增大,则同主族元素随原子核电荷数的递增,原子半径依次增大,故D正确;
故选D.
点评 本题考查元素周期律和元素周期表的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素的特性及规律性知识的应用,题目难度不大.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
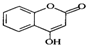 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: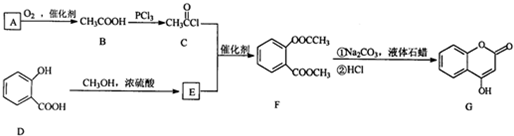
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键只存在于分子内,分子间作用力只存在于分子间 | |
| B. | 冰变为液态水时,共价键没有被破坏 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 物质在溶于水的过程中,化学键一定会被破坏或改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +5,-3 | -2 |
| A. | GOH溶液和M(OH)3可以相互反应 | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-核外电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com