
(14分)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成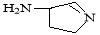 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
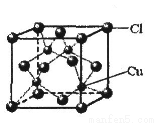
(6)铜的某氯化物的晶胞结构如图所示,该化合物的化学式为 。
(1)N>O>S (2)SP3杂化,CCl4 (3)14∶1
(4)ACE(选对两个得1分,只要选错得0分)
(5)1S22S22P63S23P63d10或[Ar] 3d10 (6)CuCl
【解析】
试题分析:(1)氮原子最外层p能级是半充满,稳定,第一电离能能比氧的大,同主族从上到下第一电离能逐渐减小,故为N>O>S;(2) SO42-离子中价层电子对数为4+1/2(6+2―4×2)=4,孤电子对数为0,SP3杂化,所以是正四面体构型.原子个数相等且价电子数相等的微粒为等电子体,与SO42-互为等电子体的分子如:CCl4 ;(3)共价单键是σ键,共价双键中一个是σ键一个是π键,该物质中含有14个σ键1个是π键,所以分子中σ键与π键之比为14:1;(4)[Cu (NH3 )4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键,故选ACE;(5)NH4CuSO3中的金属阳离子是Cu+,基态Cu+核外有28个电子,根据构造原理知其核外电子排布式为:1S22S22P63S23P63d10或[Ar]3d10;(6)该晶胞中铜原子个数是4,氯原子个数=8×1/8+6×1/2=4,所以其化学式为:CuCl;
考点:第一电离能、杂化类型的判断、化学键类型的判断、晶胞的计算等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性
C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
D.汽车尾气的净化反应2NO+2CO 2CO2+N2 △H<0,则该反应一定能自发进行
2CO2+N2 △H<0,则该反应一定能自发进行
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
只用下表提供的仪器、试剂,就能达到相应实验目的的是( )
选项 | 仪器 | 试剂 | 相应实验目的 |
A | 托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
B | 烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 | AlCl3溶液(含少量MgCl2),烧碱,CO2,稀盐酸 | 除去AlCl3溶液中少量的MgCl2 |
C | 酸式滴定管、滴管、铁架台(带铁夹) | 已知浓度的盐酸,未知浓度的NaOH溶液 | 测定NaOH溶液的浓度 |
D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸,大理石,硅酸钠溶液 | 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
A.R的原子半径比Z的大
B.R的氢化物的热稳定性比W的强.
C.X与Y形成的化合物只有一种
D.Y的最高价氧化物的水化物的酸性比W的强
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分)图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据题意回答下列问题

(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容 器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
CO或NO的转化率 | α1 | α2 | α3 |
则:α1+α2= , a+b/2= ,m=
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红; ②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
A.①②③④ B.②③④ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在周期表中金属和非金属的分界处寻找催化剂和耐高温、耐腐蚀的合金材料
B.元素性质随着核电荷数的递增而呈周期性的变化叫元素周期律
C.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
D.相对分子质量相同,而结构不同的化合物互称为同分异构体
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省2013-2014学年高三模拟考试化学试卷(解析版) 题型:填空题
(14分)由A、D、E、G四种微粒组成的复盐W的化学式为xAaDd·yE2D·zG。4.704gW溶于水得一澄清的弱酸性溶液,其中溶质总量为3.408g。同质量的W与5.13g氢氧化钡充分混匀后加热,生成的气体以足量铝盐溶液充分吸收得Al(OH)3 0.624g,加热后的残渣用水充分溶解后过滤,滤液以酚酞为指示剂用0.400mol/L H2SO4滴定至终点,用去H2SO4 15.0mL,滴定完毕后,溶液中检测不出任何金属离子和酸根离子;滤渣用硝酸洗涤时部分溶解,得一遇石炭酸显紫色的黄色溶液,依据推理和计算判断:
(1)依次写出D、E、G三种微粒符号___ _____、___ ____、____ _____;
(2)a、d的比值为____ _____;
(3)复盐的化学式为___ _____。(写出计算步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com