

分析 分析题图:图示表示分子式为C55H70O19N10的多肽彻底水解后得到的四种氨基酸,这四种氨基酸都只含有一个氨基,根据多肽的分子式中含有十个N可推测出该多肽是十肽,则十肽形成过程中脱去了9个水分子,形成9个肽键.四种氨基酸中,只有谷氨酸含有4个O原子,其它三种氨基酸都含有2个O原子,所以以O原子作为突破口,算出谷氨酸的分子数目.
解答 解:(1)由于四种氨基酸都只含有一个氨基,根据多肽的分子式中含有十个N可推测出该多肽是十肽,连接相邻两个氨基酸之间的化学键是肽键,结构式是-CO-NH-,故答案为:十;-CO-NH-;
(2)根据图解可知,谷氨酸含有4个O原子,其它三种氨基酸都含有2个O原子,所以以O原子作为突破口,设谷氨酸为X个,则4X+(10-X)×2=19+9,可求出X=4个.因此,该多肽进行水解,需9个水分子参与,得到4个谷氨酸分子.设苯丙氨酸为a个,甘氨基为b个,丙氨酸为c个,根据C原子守恒,所以9a+2b+3c=55-5×3=40,a+b+c=10-3=7,所以7a+c=26,(a、c为小于6的整数),所以a=3.即3个苯丙氨酸,每种氨基酸分子至少都有一个氨基和一个羧基,并且都有一个氨基和一个羧基连接在同一个碳原子上,故答案为:9;4;3; 在同一个碳原子上,分别连接了一个氨基、一个羧基和一个氢原子;
(3)蛋白质分子结构复杂,经加热、X射线、强酸、强碱、重金属盐等的作用,引起蛋白质的变性,其原因主要是蛋白质空间结构发生变化,故答案为:破坏了蛋白质的空间结构;
(4)脱水缩合后形成的含四个肽键的分子是由5个氨基酸形成,所以最多可有45=1024种,故答案为:1024.
点评 本题结合多肽的分子式和四种氨基酸的结构,考查蛋白质的合成--氨基酸脱水缩合,首先要求考生分析四种氨基酸的结构特点,找出规律,明确四种氨基酸都只含有一个氨基,以N原子数目为突破口,推测该多肽为十肽,题目难度中等.


科目:高中化学 来源: 题型:解答题
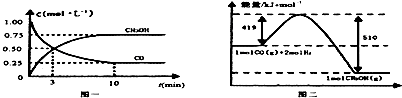
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固态焦炭与1mol水蒸气反应产生1mol一氧化碳和1mol氢气,吸收131.3 kJ的热量 | |
| B. | 碳与水反应吸收131.3 kJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1的CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL0.1mol•L-1H2SO4与10mL 0.01mol•L-1NaOH溶液充分混合,若混合后的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强弱电解质的区别是溶液的导电能力大小 | |
| B. | 溶液与胶体的本质区别是有无丁达尔效应 | |
| C. | 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| D. | 约含6.02×1023个Na+的Na2O2投入水中配成1L溶液,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液里含有NA个SO42- | |
| B. | 1L溶液里K+离子数比SO42-离子数少NA个 | |
| C. | 2L溶液里,阴、阳离子的总数大于4NA个 | |
| D. | 2L溶液里,Al3+离子个数一定小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com