
| A. | 伐薪烧炭 | B. | 酿酒成醋 | C. | 滴水成冰 | D. | 百炼成钢 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中只存在共价键,一定不含有离子键 | |
| C. | 金属晶体的熔沸点均很高 | |
| D. | 分子晶体中一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
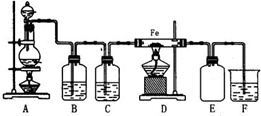 实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:
实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L由H2和O2组成的混合气体,所含分子总数为NA | |
| B. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| C. | 常温常压下,1 mol氖气含有的原子数为NA | |
| D. | 1L1 mol.L-l FeCl3溶液中Fe3+的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
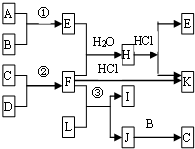 如图是部分短周期元素的单质及其化合物的转化关系图
如图是部分短周期元素的单质及其化合物的转化关系图| 溶液酸碱性 | 离子浓度大小顺序 | |
| 1 | 酸性 | |
| 2 | 中性 | |
| 3 | 碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据碳酸盐与盐酸反应能放出二氧化碳气体,确定某矿石中是否含碳酸盐 | |
| B. | 根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维 | |
| C. | 根据加入氯化钡溶液的方法来检验溶液中是否含有硫酸根离子 | |
| D. | 根据氨气能使湿润的红色石蕊试纸变蓝色,可以用于铵根离子的检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 [Al(OH)2]++H+.
[Al(OH)2]++H+.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com